题目内容
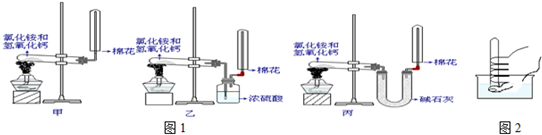
如图1所示是实验室中制取气体的一种简易装置.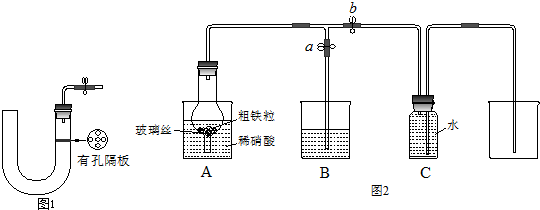
(1)请简述检验它的气密性的方法
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)
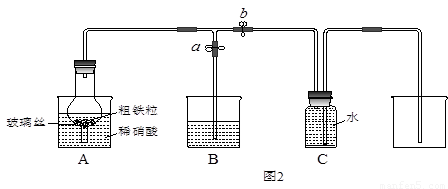
(3)某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH
| 高温 |
a.HNO3的氧化性比KNO3弱
b.反应的温度不够
c.HNO3的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/L KSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/L KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写表中实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试 管中滴入几滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
(2)该装置属于固液混合不加热型装置,根据反应物的状态和反应条件来确定制取的气体;
(3)c=
| 1000ρw |
| M |
(4)铁和稀硝酸反应生成无色的一氧化氮,一氧化氮能被空气氧化生成二氧化氮;二氧化氮能被碱液吸收;
(5)FeO42-属于弱酸根离子,不能和大量氢离子共存;
(6)铁离子能和硫氰化钾溶液反应络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应;
亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化.
故答案为:关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好;
(2)该装置属于固液混合不加热型装置,用有孔隔板放置固体,所以反应物必须是不溶于水的块状固体,且该反应不需要加热,故答案为:不溶于水的块状固体、不需要加热而反应生成的;
(3)c=
| 1000ρw |
| M |
| 1000×1.10×16.9% |
| 63 |
配制过程中还需要量筒量取浓硝酸,故答案为:2.95mol/L;量筒;
(4)铁和稀硝酸反应生成一氧化氮,一氧化氮会迅速被氧化为二氧化氮,所以A装置的干燥管中观察到的现象是:有红棕色气体出现,二氧化氮有毒,属于酸性气体,可以用烧碱溶液吸收,
故答案为:有红棕色气体出现;吸收NO2;
(5)FeO42-属于弱酸根离子,不能和大量氢离子共存,即FeO42-不能存在于酸性溶液中,故选d;
(6)铁离子能和硫氰化钾溶液反应络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应;
亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,
如果向溶液中滴加硫氰化钾溶液,溶液变为血红色就说明含有铁离子,否则不含铁离子;
如果向溶液中滴加酸性高锰酸钾溶液,如果酸性高锰酸钾溶液褪色,就说明含有亚铁离子,否则不含亚铁离子,故答案为:若溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+;
取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案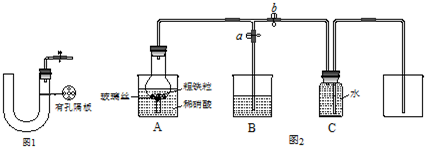
(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
如图1所示是实验室中制取气体的一种简易装置。
(1)请简述检验它的气密性的方法??????????????????????????????????????? 。
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为________________________。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。

(3)已知16.9%稀硝酸的密度为1.10g·cm-3,则其物质的量浓度为____________(计算结果保留两位小数)。若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、???????????? 。
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是???????????????? 。B装置烧杯中液体的作用是_________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)现有仪器和药品:试管和胶头滴管,0.1mol·L-1KSCN溶液、0.2mol·L-1酸性KMnO4溶液、0.1mol·L-1KI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤 | 操作 | 现象与结论 |
第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液。 |
|
第二步 |
| 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+。 |
如图1所示是实验室中制取气体的一种简易装置。
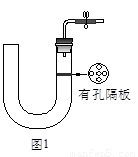
(1)请简述检验它的气密性的方法_______________________。
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)________________________气体。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为____________(计算结果保留两位小数)。用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和 。
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是_______________________。B装置烧杯中液体的作用是__________________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH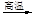 2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
a.HNO3 的氧化性比KNO3弱
b.反应的温度不够
c.HNO3 的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
|
实验步骤 |
操作 |
现象与结论 |
|
第一步 |
取少量液体装于试管,向试 管中滴入几滴KSCN溶液。 |
|
|
第二步 |
|
若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+。 |