题目内容
(13分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.
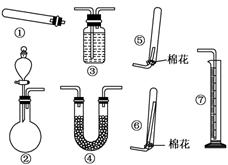
(1)若用装置①制取NH3,其反应的化学方程式为_______________________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________________________________________.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是_____________________,分液漏斗中装的试剂是_________________,收集装置应选择________(填装置序号).
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积(标准状况)如下表:
试剂:6.0 g Ca(OH)2(s,过量),6.0 g CaO(s,过量),5.4 g NH4Cl(s),5.4 g (NH4)2SO4(s).
|
试剂组合 |
①Ca(OH)2 NH4Cl |
②Ca(OH)2(NH4)2SO4 |
③CaO NH4Cl |
④CaO(NH4)2SO4 |
|
NH3体积( mL) |
1344 |
1364 |
1792 |
1753 |
从表中数据分析,实验室制氨气的产率(产率=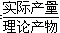 ×100%)最高的是________(填序号),其原因是_____________________________________________________________
×100%)最高的是________(填序号),其原因是_____________________________________________________________
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O ③⑦ 氨气难溶于该试剂,该试剂不易挥发,不与氨气反应
2NH3↑+CaCl2+2H2O ③⑦ 氨气难溶于该试剂,该试剂不易挥发,不与氨气反应
(2)CaO或NaOH或碱石灰 浓氨水或浓NH4Cl溶液[注:用Ca(OH)2溶液不给分] ⑥
(3)④ 因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高
【解析】(3)①与③比较,排除①;②与④比较,排除②;5.4 g NH4Cl为0.101 mol,理论上可生成0.101 mol氨气,产率(③)= =79.2%;5.4 g(NH4)2SO4为0.041 mol,可生成气体0.082 mol,产率(④)=
=79.2%;5.4 g(NH4)2SO4为0.041 mol,可生成气体0.082 mol,产率(④)=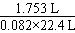 =95.4%.
=95.4%.

名称 | 密度/g·cm-3 | 沸点/℃ | 溶解性 |
苯甲酸 | 1.265 9 | 249 | 微溶于水、易溶于有机溶剂 |
甲醇 | 0.791 5 | 64.65 | 易溶于水、易溶于有机溶剂 |
苯甲酸甲酯 | 1.093 7 | 199 | 难溶于水、易溶于有机溶剂 |
硫酸 | 1.834 | 338 | 易溶于水 |
(1)某同学用如下图一所示的装置制备苯甲酸甲酯,结果发现锥形瓶中没有收集到苯甲酸甲酯,原因是____________________________________________________________________。

(2)该同学在分析实验失败的原因后,决定改用图二的装置进行,向烧瓶中加入浓硫酸、15 g苯甲酸、20 mL甲醇和_________________,冷却水从_________________处进。
(3)反应一段时间后,取下烧瓶,冷却后向其中加入一定量的水,分液,将分液漏斗_________________ (填“上”或“下”)层中的液体移入装有少量固体碳酸钠的锥形瓶中,过滤,碳酸钠的作用是_________________。
(4)将滤液倒入蒸馏装置中进行蒸馏,温度计应如何放置______________________________。
(5)将得到的苯甲酸甲酯进行称量,质量为13.6 g,则苯甲酸的转化率为_________________。
 (1)甲物质只含有碳、氢两种元素,在标准状况下为气态,有机物甲的产量可以用来衡量一个国家的石油化工发展水平.工业上可以用丙物质来生产甲物质,反应式表示:
(1)甲物质只含有碳、氢两种元素,在标准状况下为气态,有机物甲的产量可以用来衡量一个国家的石油化工发展水平.工业上可以用丙物质来生产甲物质,反应式表示: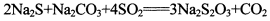 o
o
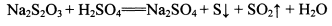
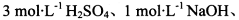 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
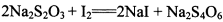 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用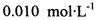 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得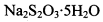 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
 某同学用如右图所示的实验装置制取W,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
某同学用如右图所示的实验装置制取W,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。