题目内容
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按如图1所示流程制备氯化铜晶体(CuCl2?2H20).
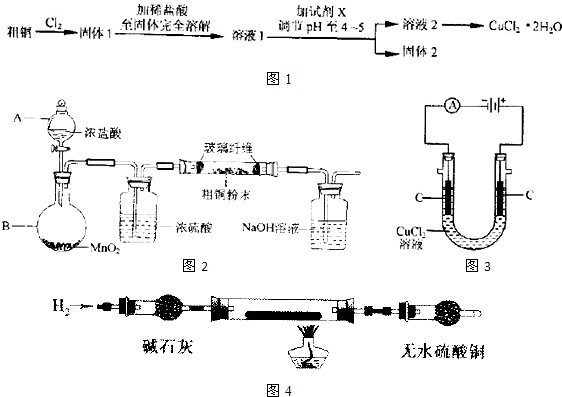
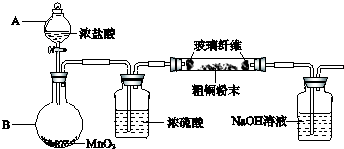
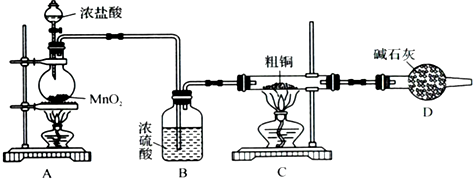
(1)实验室采用如图2所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①装置B中发生反应的离子方程式是
②有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装胃,你认为是否必要
(2)试剂X用以除去杂质,X可选用下列试剂中的
a. NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色出蓝色变为绿色.小组同学欲探究其原因.
己知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)(蓝色)+4Cl-(aq)?CuCl42-(aq)(黄色)+4H2O(l)
①上述反应的化学平衡常数表达式是K=
.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能证明CuCl2溶液中有上述转化关系的是(填序号)
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入NaCl固体,溶液变为绿色
c.取Y进行电解,溶液颜色最终消失
(4)如图3所示,用石墨电极电解CuCl2溶液,小组同学发现阴极碳棒上有红色和白色两种颜色的固体析出.有关文献资料表明,在铜和铜的化合物中Cu为紫红色,Cu2O为红色,CuCl为白色,它们都不溶于水.
①小组同学将阴极碳棒洗涤干净并干燥后,放入玻璃管中,按如图4所示连接装置.排净装置中的空气后,充分加热,并将一张湿润的蓝色石蕊试纸置于装置末端的导管口附近.实验中发现,碳棒上的白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色.根据上述现象,玻璃管中发生反应的化学方程式为
②电解CuCl2溶液时,阴极发生反应的电极方程式为

(1)实验室采用如图2所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①装置B中发生反应的离子方程式是
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
②有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装胃,你认为是否必要
否
否
(填“是”或“否”).(2)试剂X用以除去杂质,X可选用下列试剂中的
cd
cd
(填序号).a. NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色出蓝色变为绿色.小组同学欲探究其原因.
己知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)(蓝色)+4Cl-(aq)?CuCl42-(aq)(黄色)+4H2O(l)
①上述反应的化学平衡常数表达式是K=
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
不变
不变
.②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能证明CuCl2溶液中有上述转化关系的是(填序号)
abc
abc
.a.将Y稀释,发现溶液呈蓝色
b.在Y中加入NaCl固体,溶液变为绿色
c.取Y进行电解,溶液颜色最终消失
(4)如图3所示,用石墨电极电解CuCl2溶液,小组同学发现阴极碳棒上有红色和白色两种颜色的固体析出.有关文献资料表明,在铜和铜的化合物中Cu为紫红色,Cu2O为红色,CuCl为白色,它们都不溶于水.
①小组同学将阴极碳棒洗涤干净并干燥后,放入玻璃管中,按如图4所示连接装置.排净装置中的空气后,充分加热,并将一张湿润的蓝色石蕊试纸置于装置末端的导管口附近.实验中发现,碳棒上的白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色.根据上述现象,玻璃管中发生反应的化学方程式为
2CuCl+H2
2Cu+2HCl
| ||
2CuCl+H2
2Cu+2HCl
.
| ||
②电解CuCl2溶液时,阴极发生反应的电极方程式为
Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl
Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl
.分析:(1)①装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水.
②HCl对反应没有影响.
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,不能引入新杂质.
(3)①生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为平衡常数,注意水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去;平衡常数只受温度影响,与离子浓度无关.
②根据平衡移动原理分析.
(4)①根据实验现象:白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色,说明CuCl被氢气还原为Cu,同时生成酸性气体;
②由题意可知在阴极上Cu2+得电子生成Cu和CuCl.
②HCl对反应没有影响.
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,不能引入新杂质.
(3)①生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为平衡常数,注意水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去;平衡常数只受温度影响,与离子浓度无关.
②根据平衡移动原理分析.
(4)①根据实验现象:白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色,说明CuCl被氢气还原为Cu,同时生成酸性气体;
②由题意可知在阴极上Cu2+得电子生成Cu和CuCl.
解答:解:(1)①装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O.
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O.
②HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置.
故答案为:否.
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,且不能引入新杂质.
a.NaOH引入杂质钠离子,故a错误;
b.NH3?H2O 引入铵根离子,故b错误;
c.CuO可以调节PH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3 可以调节PH值,除去杂质,过量的Cu2(OH)2CO3 过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节PH值,引入硫酸根离子,故e错误;
故选:cd.
(3)①Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)的平衡常数为k=
CuCl42-(aq)+4H2O(l)的平衡常数为k=
.
平衡常数只受温度影响,与离子浓度无关,增大氯离子浓度,K值不变.
故答案为:
;不变.
②a.将Y稀释,平衡向作反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故选:abc.
(4)①根据实验现象:白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色,说明CuCl被氢气还原为Cu,同时生成酸性气体,其反应方程为:2CuCl+H2
2Cu+2HCl;故答案为:2CuCl+H2
2Cu+2HCl;
②由题意可知在阴极上Cu2+得电子生成Cu和CuCl,所以阴极上电极反应方程为:Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl;故答案为:Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl.
| ||
故答案为:MnO2+4H++2Cl-
| ||
②HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置.
故答案为:否.
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,且不能引入新杂质.
a.NaOH引入杂质钠离子,故a错误;
b.NH3?H2O 引入铵根离子,故b错误;
c.CuO可以调节PH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3 可以调节PH值,除去杂质,过量的Cu2(OH)2CO3 过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节PH值,引入硫酸根离子,故e错误;
故选:cd.
(3)①Cu(H2O)42+(aq)+4Cl-(aq)
 CuCl42-(aq)+4H2O(l)的平衡常数为k=
CuCl42-(aq)+4H2O(l)的平衡常数为k=| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
平衡常数只受温度影响,与离子浓度无关,增大氯离子浓度,K值不变.
故答案为:
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
②a.将Y稀释,平衡向作反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故选:abc.
(4)①根据实验现象:白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色,说明CuCl被氢气还原为Cu,同时生成酸性气体,其反应方程为:2CuCl+H2
| ||
| ||
②由题意可知在阴极上Cu2+得电子生成Cu和CuCl,所以阴极上电极反应方程为:Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl;故答案为:Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl.
点评:本题考查学生对工艺流程理解、实验装置的理解、平衡移动、平衡常数,物质分离提纯,电解原理等,难度中等.

练习册系列答案
相关题目