题目内容
金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:
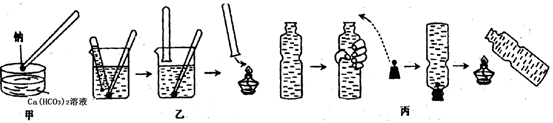
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是_________(填字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→__________→用镊子夹取金属钠投入到盛有Ca(HCO3)2溶液的水槽中。
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是 。
A.用铝箔包住钠 B.用锡箔包住钠 C.直接将钠投入的水中
(4)用装满水的矿泉水瓶按图丙方法进行实验,(用手挤压矿泉水瓶共排出水的体积为112 mL)塞紧带有钠的塞子,反应结束后,干瘪的带塞矿泉水瓶恰好恢复成原状,假设瓶内、瓶外均属于标准状况,则所用金属钠的质量是多少克?(写出计算过程)

(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是_________(填字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→__________→用镊子夹取金属钠投入到盛有Ca(HCO3)2溶液的水槽中。
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是 。
A.用铝箔包住钠 B.用锡箔包住钠 C.直接将钠投入的水中
(4)用装满水的矿泉水瓶按图丙方法进行实验,(用手挤压矿泉水瓶共排出水的体积为112 mL)塞紧带有钠的塞子,反应结束后,干瘪的带塞矿泉水瓶恰好恢复成原状,假设瓶内、瓶外均属于标准状况,则所用金属钠的质量是多少克?(写出计算过程)
21.(12分)(1)A B D(3分,选对1个1分,4个选项全选不得分)
(2)用滤纸吸干表面的煤油,在玻璃片上用小刀切成绿豆大小的钠粒,并将多余的钠放回试剂瓶中(2分) (3)A(2分)
(4)(5分)(列出比例式得3分,计算结果得2分)
设:所用金属钠的质量为x
2 Na + 2 H2O=2 NaOH + H2↑
2×23 g 22400 mL
X 112 mL
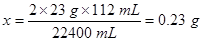
(2)用滤纸吸干表面的煤油,在玻璃片上用小刀切成绿豆大小的钠粒,并将多余的钠放回试剂瓶中(2分) (3)A(2分)
(4)(5分)(列出比例式得3分,计算结果得2分)
设:所用金属钠的质量为x
2 Na + 2 H2O=2 NaOH + H2↑
2×23 g 22400 mL
X 112 mL
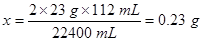
试题分析:(1)将钠投入到碳酸氢钙溶液中,钠先和水反应,呈现的现象是:钠浮在
水面上,熔化成一个光亮的小球,并四处游动,最后消失,生成的氢氧化钠和碳酸氢钙反应生成难溶性的碳酸钙,所以恢复到室温时,烧杯底部有固体物质析出,故选ABD;(2)做钠和水的反应实验时,用滤纸吸干表面的煤油,在玻璃生上用小刀切成绿豆大小的钠粒,并将多余的钠放回试剂瓶中,故答案为:用滤纸吸干表面的煤油,在玻璃生上用小刀切成绿豆大小的钠粒,并将多余的钠放回试剂瓶中;(3)钠和水反应生成氢气和氢氧化钠,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,锡和氢氧化钠溶液不反应,所以生成氢气体积最大的是用铝箔包住钠,故选A;
(4)该反应中排出水的体积就是氢气的体积,设消耗的钠的质量是x,
2 Na + 2 H2O=2 NaOH + H2↑
2×23 g 22400 mL
X 112 mL
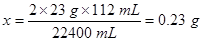
故答案为:0.23g.

练习册系列答案
相关题目
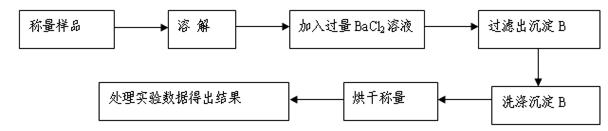
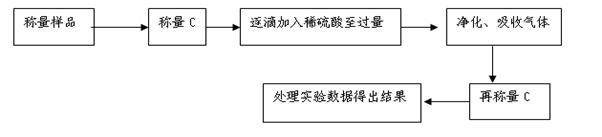
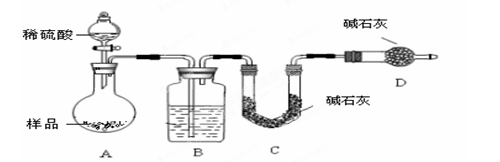
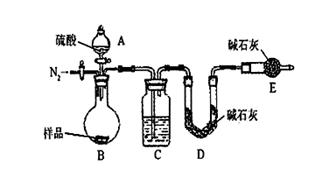
 显示消耗的盐酸溶液体积为 。
显示消耗的盐酸溶液体积为 。