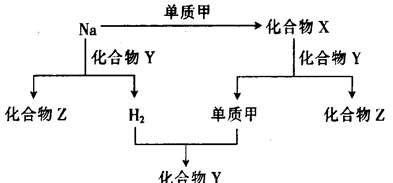
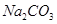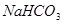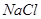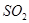题目内容
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
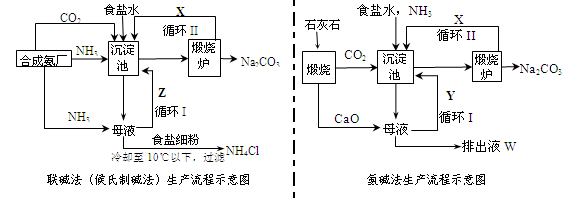
(1)两种方法的沉淀池中均发生的反应化学方程式为_____________________________。
(2)若沉淀池含800.00 mol NH3的水溶液质量为54.00 kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为______________%。
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是 ___ 。
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是_______(选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联碱法的另一项优点是__________________________________________________。
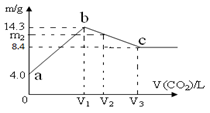
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
①第二次滴定,从图Ⅰ图Ⅱ 显示消耗的盐酸溶液体积为 。
显示消耗的盐酸溶液体积为 。
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)= 。
③该同学测定结果有一定的误差,产生该误差的原因可能是 (选填编号)。
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定

(1)两种方法的沉淀池中均发生的反应化学方程式为_____________________________。
(2)若沉淀池含800.00 mol NH3的水溶液质量为54.00 kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为______________%。
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是 ___ 。
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是_______(选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联碱法的另一项优点是__________________________________________________。
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
①第二次滴定,从图Ⅰ图Ⅱ
 显示消耗的盐酸溶液体积为 。
显示消耗的盐酸溶液体积为 。②该实验测定NaHCO3含量的计算式为ω(NaHCO3)= 。
③该同学测定结果有一定的误差,产生该误差的原因可能是 (选填编号)。
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定
(本题共12分)(1)NaCl + NH3 + CO2 +H2O →NaHCO3↓+ NH4Cl (2分)
(2)92% (2分)
(3)防止生石灰先跟溶液中的NaHCO3反应产生碳酸钙沉淀(1分)
(4)bd(2分)
(5)避免产生大量含有CaCl2的废液(或节省石灰窑、蒸氨塔等设备)(1分)
(6)①20.20mL(1分)
②ω(NaHCO3)=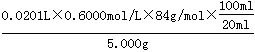 ×100% (1分) ③ac(2分)
×100% (1分) ③ac(2分)
(2)92% (2分)
(3)防止生石灰先跟溶液中的NaHCO3反应产生碳酸钙沉淀(1分)
(4)bd(2分)
(5)避免产生大量含有CaCl2的废液(或节省石灰窑、蒸氨塔等设备)(1分)
(6)①20.20mL(1分)
②ω(NaHCO3)=
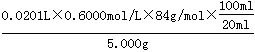 ×100% (1分) ③ac(2分)
×100% (1分) ③ac(2分)试题分析:(1)依据流程图分析可知,联碱法和氨碱法的生产流程中沉淀池中发生反应的物质是氨气、二氧化碳、水、氯化钠,这些物质反应生成碳酸氢钠晶体和氯化铵,所以反应的化学方程式为NaCl + NH3 + CO2 +H2O →NaHCO3↓+ NH4Cl。
(2)根据方程式NH3 + CO2 +H2O →NH4HCO3可知,该氨水完全反应需通入800.00molCO2,过滤得到m(NH4HCO3)=54.0kg+800.00mol×0.044kg/mol-31.20kg=58.00kg,理论上应得到m(NH4HCO3)=800.00mol×0.079kg/mol=63.2kg,所以NH4HCO3的产率为
 ×100%=92%。
×100%=92%。(3)由于生石灰溶于水生成氢氧化钙,而氢氧化钙能和碳酸氢钠反应生成碳酸钙沉淀,所以在母液中加生石灰前先要加热的原因是防止生石灰先跟溶液中的NaHCO3反应产生碳酸钙沉淀。
(4)联碱法中从母液中提取氯化铵晶体的过程中;a、母液中加入氯化钠晶体,然后冷却到10℃以下即析出氯化铵晶体,这说明室温下氯化铵的溶解度比氯化钠大,故a错误;b、通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;c、加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,d正确,答案选bd。
(5)联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.另外它综合利用了氨厂的二氧化碳和碱厂的氯离子,同时,生产出两种可贵的产品--纯碱和氯化铵。将氨厂的废气二氧化碳,转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰窑;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵,从而不再生成没有多大用处,又难于处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性,因此另外一个主要优点是避免产生大量含有CaCl2的废液(或节省石灰窑、蒸氨塔等设备)。
(6)①滴定管能读数到0.01ml,所以根据滴定管中液面的位置可知,初始读数是2.40ml,最终读数是22.60ml,所以实际消耗盐酸的体积是22.60ml-2.40ml=20.20ml。
②第一次消耗盐酸的体积是21.00ml-1.00ml=20.00ml,所以两次消耗盐酸的平均值是(20.20ml+20.00ml)÷2=20.10ml,所以消耗盐酸的物质的量是0.0201L×0.6000mol/L。根据方程式HCl+NaHCO3=NaCl+H2O+CO2↑可知,碳酸氢钠的物质的量是0.0201L×0.6000mol/L,质量是0.0201L×0.6000mol/L×84g/mol,所以碳酸氢钠的纯度是ω(NaHCO3)=
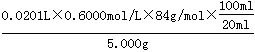 ×100%。
×100%。③a.甲基橙的变色范围是3.1~4.4,所以待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色且半分钟内不变色为止,因此a会产生误差;b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定,属于正确的操作,所以b不正确;c.滴定管必须用标准液润洗,所以滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定,会产生误差,c正确;d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定,属于正确的操作,d不正确,答案选ac。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目