题目内容
常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:2混合后溶于水配成稀溶液,下列有关该混合溶液说法正确的是
| A.溶液中c(CO32-):c(HCO3-)<1:2 |
| B.溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
| C.向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 |
| D.将混合液蒸干,水解加剧,最终得NaOH固体 |
A
试题分析:A、由于CO32-的水解程度大于HCO3-的水解程度,因此常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:2混合后溶于水配成稀溶液,则溶液中c(CO32-):c(HCO3-)<1:2,A正确;B、根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),根据物料守恒可知c(Na+)=
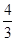 [c(H2CO3)+c(HCO3-)+c(CO32-)],解得c(OH-)=
[c(H2CO3)+c(HCO3-)+c(CO32-)],解得c(OH-)=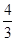 c(H2CO3)+
c(H2CO3)+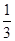 c(HCO3-)+c(H+)-
c(HCO3-)+c(H+)-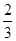 c(CO32-),B不正确;C、向混合液中滴加少量稀盐酸,盐酸与碳酸钠反应生成碳酸氢钠,因此HCO3-的物质的量增加,C不正确;D、碳酸氢钠不稳定,受热分解生成碳酸钠,因此能将混合液蒸干,最终得到碳酸钠,D不正确,答案选A。
c(CO32-),B不正确;C、向混合液中滴加少量稀盐酸,盐酸与碳酸钠反应生成碳酸氢钠,因此HCO3-的物质的量增加,C不正确;D、碳酸氢钠不稳定,受热分解生成碳酸钠,因此能将混合液蒸干,最终得到碳酸钠,D不正确,答案选A。
练习册系列答案
相关题目