题目内容
【题目】(1)关于反应H2(g)+![]() O2(g)===H2O(l),下列说法正确的是________(填字母)。
O2(g)===H2O(l),下列说法正确的是________(填字母)。
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.该反应在常温下不易被观察,因为具有较高的活化能,反应速率小
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)电渗析法淡化海水装置示意图如图所示,在电场中利用膜技术可以实现淡化海水和浓缩海水的分离。
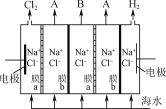
①图中膜a应选用________(填“阳离子”或“阴离子”)交换膜。
②各间隔室的排出液中,A为________(填“淡化海水”或“浓缩海水”)。
③电渗析法还可用来处理电镀废液,写出用该方法处理含AgNO3废液时所发生反应的化学反应方程式:______。
(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2 ℃)、临界压强(22.1 MPa)时的水称为超临界水。
①如果超临界水的电离度变为常温下的100倍,则此时Kw的值为____。
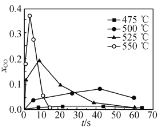
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图,其中x为以碳元素计的物质的量分数,如xCO=![]() ,t为反应时间。 CO的分布分数先增后降的原因是___。
,t为反应时间。 CO的分布分数先增后降的原因是___。
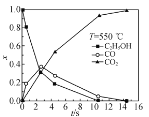
③不同温度下乙醇的超临界水氧化过程中CO的分布分数随时间变化如图所示,随着温度升高,CO分布分数峰值出现的时间提前且峰值更高的原因是________。
【答案】ABCD 阴离子 淡化海水 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 10-10 在超临界水氧化过程中,乙醇先氧化为CO,CO再氧化为CO2(CO为反应中间产物,CO2为反应最终产物) 乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
4Ag+O2↑+4HNO3 10-10 在超临界水氧化过程中,乙醇先氧化为CO,CO再氧化为CO2(CO为反应中间产物,CO2为反应最终产物) 乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
【解析】
电解海水时,氯离子在阳极区失去电子生成氯气,氯离子向阳极区移动,钠离子向阴极区移动;电解的方程式书写考虑放电顺序,银离子比氢离子先放电,生成银单质;温度升高促进水的电离,水的电离常数增大。
(1)A. 氢气在氧气中燃烧生成液态水的反应是一个放热且熵减的反应,A正确;
B. 该反应是一个自发的氧化还原反应,可以将该反应设计成原电池,将化学能转化为电能,B正确;
C. 该反应无沉淀气体生成,在常温下不易被观察,但因为具有较高的活化能,反应速率小,C正确;
D. 选用合适的催化剂,有可能使氢气和氧气在常温常压下以较快的速率进行,D正确;
所以正确的是ABCD;
(2) ①图中氯离子在左边区域失去电子生成氯气,氯离子要透过膜a,所以膜a应选用阴离子交换膜;
②A区域钠离子和氯离子都减少,所以排出液中为淡化海水;
③电渗析法处理AgNO3废液时,银离子得电子生成银单质,水中氧元素失去电子生成氧气,所以反应的化学方程式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)①常温下Kw =10-14,水电离产生的c(H+)=10-7mol/L,电离度变为常温下的100倍,则此时c(H+)=10-5mol/L,Kw =10-10;
②如图可知,乙醇的超临界水氧化过程中,CO的含量先增大再减小,CO2的含量一直增大,乙醇的含量一直减小,可见CO为反应中间产物,CO2为反应最终产物,所以CO的分布分数先增后降的原因是在超临界水氧化过程中,乙醇先氧化为CO,CO再氧化为CO2(CO为反应中间产物,CO2为反应最终产物);
③温度升高时,反应速率加快,如图可知,单位时间内乙醇氧化生成CO的速率比CO氧化生成CO2的速率快,xCO峰值出现的时间才会提前,且峰值更高,所以原因是乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大。