题目内容
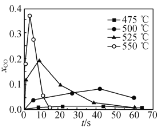
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。

下列说法中,正确的是( )
A.X代表压强B.L1<L2
C.平衡常数:K(A)=K(B)D.在C点时,CO转化率为75%
【答案】D
【解析】
A、根据勒夏特列原理,增大压强,平衡向体积减小的方向进行,根据反应方程式,增大压强应向正反应方向移动,CH3OH的体积分数增大,故错误;
B、根据A选项分析,X代表的是温度,L代表压强,增大压强,平衡向正反应方向移动,甲醇的体积分数增大,即L1>L2,故错误;
C、化学平衡常数只受温度影响,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,即向逆反应方向移动,B的温度高于A,K(A)>K(B),故错误;
D、CO(g)+2H2(g)![]() CH3COH(g)
CH3COH(g)
起始:1 2 0
变化:x 2x x
平衡:1-x 2-2x x
甲醇的体积分数x/(1-x+2-2x+x)×100%=50%,x=0.75mol,则CO的转化率为0.75/1×100%=75%,故正确;
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目