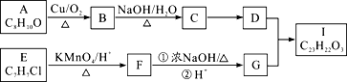
题目内容
【题目】硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
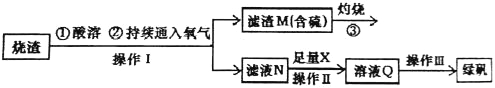
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中,溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、 、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
【答案】(1)取少量配制好的硫酸溶液,加入过量的硝酸钡溶液,充分振荡后过滤,向过滤所得的滤液中滴加硝酸酸化的硝酸银溶液,振荡,若生成白色沉淀 该溶液中含有氯离子。(2)B(3)铁粉;Fe+2Fe3+=3Fe2+;取待测液于试管中,先滴入几滴KSCN,无明显现象,滴入双氧水或氯水,溶液变血红色,则说明溶液中含有亚铁离子(4)冷却结晶;洗涤(5)13.9g
【解析】
试题分析:烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾,为了减少引入新杂质,所以用硫酸溶解并通入足量氧气,反应后过滤得到滤渣M和溶液N,滤渣M中含硫,灼烧后会产生二氧化硫,溶液N中主要溶质为硫酸铁,加入足量的铁粉反应生成硫酸亚铁,过滤除去多余的铁粉,得到硫酸亚铁溶液,将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到绿矾。
(1)设计实验证明已配制的稀硫酸中混有Cl-,首先要排除硫酸根离子的干扰,故要先用硝酸钡除去硫酸根,然后用硝酸银检验氯离子,即取少量配制好的硫酸溶液,加入过量的硝酸钡溶液,充分振荡后过滤,向过滤所得的滤液中滴加硝酸酸化的硝酸银溶液,振荡,若生成白色沉淀 该溶液中含有氯离子。
(2)过程中灼烧时产生的气体为SO2,具有还原性和漂白性及酸性氧化物的通性,能使品红褪色,能与酸性KMnO4溶液发生氧化还原反应而使其褪色,能与碱反应使红色的酚酞试液褪色,不能使紫色石蕊溶液褪色,答案选B;
(3)根据流程分析可知,溶液N中主要溶质为硫酸铁,要制得绿矾要加铁粉,反应的离子方程式为 Fe+2Fe3+=3Fe2+,检验亚铁离子的方法是取待测液于试管中,滴入几滴KSCN,无明显现象,滴入双氧水或氯水,溶液变血红色,则说明溶液中含有亚铁离子;
(4)从硫酸亚铁溶液中得到绿矾,要将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)2.8g铁元素的物质的量是0.05mol,服用的药品中相当于需要绿矾的质量为0.05mol×278g/mol=13.9g;

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案