题目内容
9.25℃时,甲溶液的pH值为12,乙溶液的pH值为10,甲溶液与乙溶液中的C(OH-)之比是( )| A. | 100 | B. | 1:100 | C. | 1:2 | D. | 2 |
分析 相同温度下,水的离子积常数相同,先根据溶液的pH计算出氢离子浓度,再根据Kw=c(OH-).c(H+)计算出氢氧根离子浓度之比.
解答 解:相同的温度下甲溶液的PH为12,则氢原子浓度为10-12 mol/L,氢氧根离子浓度=$\frac{{K}_{W}}{1{0}^{-12}}$,乙溶液的PH为10,则氢离子浓度为10-10mol/L,氢氧根离子浓度=$\frac{{K}_{W}}{1{0}^{-10}}$mol/L,所以两种溶液中氢氧根离子浓度之比=$\frac{{K}_{W}}{1{0}^{-12}}$:$\frac{{K}_{W}}{1{0}^{-10}}$mol/L=100:1,
故选A.
点评 本题考查了pH的简单计算,明确氢离子、氢氧根离子和离子积常数之间的关系是解本题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.既属于氧化还原反应又属于分解反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2H2O═H2↑+O2↑ |
20.胃酸过多会导致消化不良和胃痛,可以服用抗酸药来缓解胃部不适,下列各组成物质都属于抗酸药的是( )
| A. | NaHCO3、NaOH、Mg(OH)2 | B. | NaHCO3、Na2CO3、MgCO3 | ||
| C. | NaHCO3、MgCO3、Al(OH)3 | D. | Na2CO3、MgCO3、CaO |
17.某同学为了检验纤维素的水解产物是否为葡萄糖,他将纤维素与70%的硫酸共热后加入新制Cu(OH)2悬浊液并加热煮沸,无红色沉淀生成,以下解释正确的是( )
| A. | 纤维素水解产物中无葡萄糖 | |
| B. | 使用的硫酸过浓,只发生了脱水反应 | |
| C. | 由于水解后混合液中含有H2SO4,所以见不到红色沉淀 | |
| D. | 加热时间不够长,所以见不到红色沉淀 |
4.下列物质的电子式书写正确的是( )
| A. |  | B. | 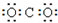 | C. |  | D. | 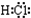 |
1.在一定条件下A与B反应可生成C和D,其能量变化如图:
下列有关反应A+B═C+D的说法正确的是( )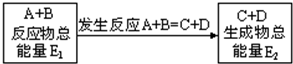
下列有关反应A+B═C+D的说法正确的是( )
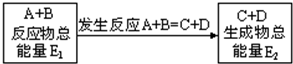
| A. | 反应前后原子的种类和数目一定不变 | |
| B. | 反应前后分子的种类和数目一定改变 | |
| C. | 反应物的总能量E1与生成物的总能量E2一定相等 | |
| D. | 若此反应为放热反应,则E2>E1 |
18.下列物质属于电解质的是
①碱石灰 ②熔融Na2O ③NaCl溶液 ④NaOH ⑤液态氧 ⑥KClO3⑦盐酸( )
①碱石灰 ②熔融Na2O ③NaCl溶液 ④NaOH ⑤液态氧 ⑥KClO3⑦盐酸( )
| A. | ①②④⑥⑦ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |