题目内容
9.下列用途中没有用到H2SO4酸性的是( )| A. | 实验室制氢气 | B. | 制硫酸铵 | C. | 干燥氧气 | D. | 除铁锈 |
分析 当硫酸体现酸性时,可与碱、碱性氧化物或盐发生复分解反应,与活泼金属反应生成氢气,据此解答.
解答 解:A.活泼金属与稀硫酸反应生成硫酸盐和氢气,体现硫酸的酸性,故A正确;
B.氨气为碱性气体,与硫酸反应生成硫酸铵,体现硫酸的酸性,故B正确;
C.浓硫酸具有吸水性,能够干燥氧气,体现吸水性,故C错误;
D.硫酸与金属三氧化二铁反应生成硫酸铁和水,体现硫酸的酸性,故D正确;
故选:C.
点评 本题考查了硫酸的性质,熟悉浓硫酸的强氧化性、脱水性、吸水性、酸性等性质是解题关键,题目不难,注意相关基础知识的学习.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
20.下列叙述不正确的是( )
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 在铁制品上镀铜时,镀件(待镀金属)为阳极,铜盐为电镀液 | |
| D. | 铁制钥匙表面镀上一层锌,钥匙不易被腐蚀 |
1.下列各物质的状态与众不同的是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CH3CH2Br | D. | CCl4 |
17.化学是以实验为基础的科学,下列关于各实验装置的叙述正确的是( )

| A. | 装置①常用于互溶但沸点不同的液体混合物的分离 | |
| B. | 用装置②可除去NO2中的NO | |
| C. | 装置③可用于吸收NH3或HCl气体,并防止倒吸 | |
| D. | 装置④可用于制备Fe(0H)2并能 较长时间观察其颜色 |
4.(1)前三周期元素中第一电离能最小的是Na(填元素符号),其基态原子的电子排布式为1s22s22p63s1.第二周期非金属元素形成的氢化物中化学键极性最大的是HF(填分子式),该物质在CCl4中的溶解度比在水中的溶解度小(填“大”或“小”).
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异.根据下表数据,形成分子间氢键的物质是B(填物质字母代号).
(3)晶格能的大小:MgO>NaCl,键能的大小:HBr>HI.(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是B
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr.
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异.根据下表数据,形成分子间氢键的物质是B(填物质字母代号).
| 代号 | 物质 | 结构式 | 水中溶解度/g(25℃) | 熔点/℃ |
| A | 邻-硝基苯酚 | 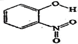 | 0.2 | 45 |
| B | 对-硝基苯酚 | 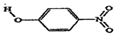 | 1.7 | 114 |
(4)下列物质的熔点高低顺序,正确的是B
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr.
14.下列关于物质结构的叙述中正确的是( )
| A. | 分子晶体中一定含有共价键 | |
| B. | 离子晶体中一定含有离子键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有非极性键的分子一定是非极性分子 |
1.向等物质的量浓度的MgSO4和NaHSO4的混合溶液中逐滴滴入一定量的Ba(OH)2溶液,下列离子方程式与事实不相符的是( )
| A. | H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-=Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | 3Mg2++2H++4SO42-+4Ba2++8OH-=3Mg(OH)2↓+4BaSO4↓+2H2O |
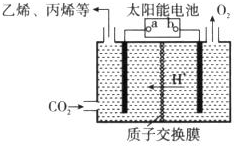
 能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.