题目内容
NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是
| A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C |
| B.同周期的三种元素的得电子能力由大到小的顺序为: O>N>C |
| C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OHˉ NH3↑+H2O NH3↑+H2O |
D
解析试题分析:A.H是第一周期的元素,原子核外有一个电子层,C、N、O都是第二周期的元素,原子核外有两个电子层。对于电子层数不同的元素来说,原子的电子层数越多原子半径越大;对于电子层数相同的元素来说,元素的原子序数越大,原子半径就越小。所以这四种元素的原子半径由小到大的顺序是H<O<N<C。正确。B.同周期的三种元素从左到右,元素的非金属性逐渐增强,元素的原子得到电子的能力逐渐增强。故得电子能力由大到小的顺序为: O>N>C 。正确。C.加热时NH4HCO3发生分解反应:NH4HCO3 NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ
NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ NH3↑+H2O + CO32-.错误。
NH3↑+H2O + CO32-.错误。
考点:考查元素的原子半径的比较、元素的原子得到电子能力的大小及NH4HCO3的化学性质的知识。

硅及其化合物在材料领域中应用广泛,下列叙述正确的是
| A.硅单质是制造玻璃的主要原料 |
| B.CaSiO3可用来制造太阳能电池 |
| C.水泥的主要成分是Na2SiO3、CaSiO3和SiO2 |
| D.二氧化硅是制造光导纤维的材料 |
自来水用氯气杀菌消毒。不法商贩用自来水冒充纯净水出售。可用来辨别其真假的一种化学试剂是
| A.酚酞溶液 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.硝酸银溶液 |
下列溶液能用来区别SO2和CO2气体的是
| A.石灰水 | B.酚酞溶液 | C.BaCl2溶液 | D.品红溶液 |
下列说法正确的是
| A.二氧化硫具有漂白性,所以可以使溴水褪色 |
| B.硫在少量氧气中燃烧生成二氧化硫,在过量氧气中燃烧生成三氧化硫 |
| C.雷雨天氮元素可以进行下列转化:N2→NO→NO2→HNO3 |
| D.氮气的化学性质非常稳定,不支持任何物质的燃烧 |
室温时将H2S、O2和N2的混合气体120mL点燃后反应至完全,恢复至室温测得剩余气体的体积为60mL。则原混合气体中硫化氢和氧气的体积比不可能为
| A.1∶1 | B.1∶2 | C.2∶3 | D.4∶3 |
目前,很多自来水厂用氯气杀菌、消毒。下列关于氯气的性质描述正确的是
| A.无味 | B.无毒 | C.黄绿色 | D.不溶于水 |
下列物品或设备:①门窗玻璃,②水晶镜片,③石英钟表,④玛瑙首饰,⑤硅太阳能,⑥光导纤维,⑦计算机芯片。所用材料为SiO2或要用到SiO2的是( )
| A.①②③④⑥ | B.全部 | C.⑤⑦ | D.①②⑥⑦ |
二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(如图)。下列说法
正确的是( )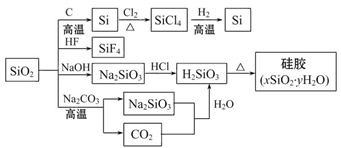
| A.SiO2属于两性氧化物 |
| B.盛放Na2CO3溶液的试剂瓶不能用玻璃塞 |
| C.硅胶吸水后不能重复再利用 |
| D.图中所示的转化反应都是氧化还原反应 |