题目内容
室温时将H2S、O2和N2的混合气体120mL点燃后反应至完全,恢复至室温测得剩余气体的体积为60mL。则原混合气体中硫化氢和氧气的体积比不可能为
| A.1∶1 | B.1∶2 | C.2∶3 | D.4∶3 |
B
解析试题分析:若氧气足量,则 2H2S+3O2= 2SO2+2H2O △V
2 3 3
40 60 60
所以氧气的量应大于或等于60mL,但小于80 mL(有氮气),硫化氢和氧气的体积比1/1.5和1/2之间,[1/1.5,1/2),,不能为1/2,B答案错误;
若氧气不足量,则 2H2S+O2= 2S+2H2O △V
2 1 3
40 20 60
所以硫化氢的量应大于等于40mL,但小于100 mL(有氮气),硫化氢和氧气的体积比在2和5之间,[2,5)。
考点:考查化学计算问题。

练习册系列答案
相关题目
关于硅及其化合物的叙述中,不正确的是
| A.硅是良好的半导体材料 |
B.二氧化硅能与石灰石反应:SiO2+CaCO3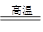 CaSiO3+CO2↑ CaSiO3+CO2↑ |
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C 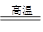 Si +2CO↑ Si +2CO↑ |
| D.水泥的主要成分是 Na2SiO3、CaSiO3和 SiO2 |
NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是
| A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C |
| B.同周期的三种元素的得电子能力由大到小的顺序为: O>N>C |
| C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OHˉ NH3↑+H2O NH3↑+H2O |
向50 mL 18 mol·LH2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量是
| A.小于0.45 mol | B.等于0.45 mol |
| C.在0.45 mol和0.9 mol之间 | D.大于0.9 mol |
关于由 37Cl原子组成的氯气叙述正确的是
| A.71g该氯气样品含1摩尔氯气 |
| B.22.4L该氯气样品质量是74g |
| C.37g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37ClO3,氧化剂和还原剂的质量之比为5:1 |
| D.0.1摩尔氯气分子溶于水形成1000mL溶液,溶液中c(Cl-)+ c(ClO-)=0.1mol/L |
下列气体有颜色和有刺激性气味的是
| A.CO2 | B.Cl2 | C.O2 | D.CO |
下列溶液中不存在氯离子的是
| A.氯水 | B.氯化氢溶液 | C.漂白粉溶液 | D.氯酸钾溶液 |
将过量的CO2分别通入①CaC12溶液;②Na2SiO3溶液;③Ca(C1O)2溶液;④饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是
| A.①②③④ | B.②④ | C.①②③ | D.②③ |
下列叙述中正确的是( )
| A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆 |
| B.浓硝酸储罐泄漏时,可以立即喷撒消石灰或烧碱处理 |
| C.浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气 |
| D.分别充满NH3、HCl气体的烧瓶倒置于水中后液面均迅速上升,说明NH3和HCl气均易溶于水 |