题目内容
自来水用氯气杀菌消毒。不法商贩用自来水冒充纯净水出售。可用来辨别其真假的一种化学试剂是
| A.酚酞溶液 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.硝酸银溶液 |
D
解析试题分析:由于自来水一般用氯气消毒,因此自来水中含有氯离子,可以通过检验氯离子来验证。检验氯离子的试剂是硝酸银溶液,实验现象是变浑浊,有白色沉淀产生,D正确,答案选D。
考点:考查离子检验的判断

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
丰富多彩的颜色变化为化学增添了许多魅力,下列有关实验中颜色变化不符合事实的是( )
| A.氨气通人酚酞试液,溶液变红色 |
| B.品红溶液中通入SO2,溶液褪色,加热后红色复原 |
| C.向淀粉KI溶液中滴人几滴氯水,溶液变蓝 |
| D.向紫色石蕊试液中通Cl2,溶液先变红后褪色,加热后紫色复原 |
某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是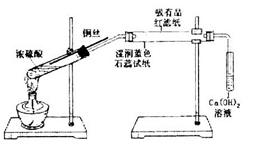
| A.湿润的蓝色石蕊试纸先变红后褪色 |
| B.左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性 |
由下列实验事实得出结论错误的是
| A.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性 |
| B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性 |
| C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性 |
| D.SO2能使紫红色的酸性高锰酸钾溶液褪色,说明SO2具有漂白性 |
关于硅及其化合物的叙述中,不正确的是
| A.硅是良好的半导体材料 |
B.二氧化硅能与石灰石反应:SiO2+CaCO3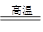 CaSiO3+CO2↑ CaSiO3+CO2↑ |
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C 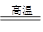 Si +2CO↑ Si +2CO↑ |
| D.水泥的主要成分是 Na2SiO3、CaSiO3和 SiO2 |
下列气体中,对人体无毒害作用的是
| A.Cl2 | B.N2 | C.NH3 | D.SO2 |
NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是
| A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C |
| B.同周期的三种元素的得电子能力由大到小的顺序为: O>N>C |
| C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OHˉ NH3↑+H2O NH3↑+H2O |
关于由 37Cl原子组成的氯气叙述正确的是
| A.71g该氯气样品含1摩尔氯气 |
| B.22.4L该氯气样品质量是74g |
| C.37g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37ClO3,氧化剂和还原剂的质量之比为5:1 |
| D.0.1摩尔氯气分子溶于水形成1000mL溶液,溶液中c(Cl-)+ c(ClO-)=0.1mol/L |
将过量的CO2分别通入:①CaCl2溶液;②Na2SiO3溶液;③Ca(ClO)2溶液;④Ca(OH)2溶液,最终有沉淀析出的是
| A.①②③④ | B.② | C.①③④ | D.②③④ |