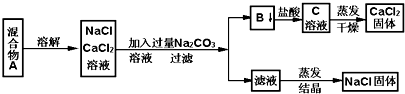
题目内容
2.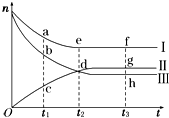 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.请回答下列问题:
(1)图中属于氢气物质的量随时间变化的曲线是Ⅲ (填“Ⅰ”、“Ⅱ”或“Ⅲ”).
(2)关于t2时刻的说法正确的是CD.
A.t2时该反应达到平衡状态
B.t2时Ⅱ和Ⅲ代表的物质反应速率相同
C.t2时氢气、氮气与氨气的反应速率之比为3:1:2
D.t2时氨气与氢气的物质的量相同
(3)对于Ⅱ所代表的物质,其逆反应速率最大的点是g(填“c”、“d”或“g”);对于Ⅰ所代表的物质,其正反应速率最小的点是f(填“a”、“e”或“f”).
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是A.
A.673K B.273K C.373K
(5)在密闭容器中充入2mol N2和6mol H2,一定条件下建立平衡:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为165.96kJ.若与上述反应的温度和体积相同时,向密闭容器中充入4mol NH3,则达平衡后,反应吸收(填“放出”或“吸收”)的热量为18.44kJ.
分析 (1)以及化学方程式中的化学计量数和图象中物质的量的变化分析;
(2)t2时刻氢气和氨气的物质的量相等,反应未达到平衡状态,速率正比的与化学计量数之比相等,据此判断;
(3)合成氨开始后,正反应速率逐渐减小,逆反应速率逐渐增大,到平衡后,正逆反应速率相等,正反应速率最小,逆反应速率增大;
(4)合成氨是反应放热,温度改变后,n(H2)比图象中的值大,说明平衡逆向移动,温度升高平衡逆向移动;
(5)1mol氮气反应放热92.2KJ,据参加反应的氮气的物质的量判断放热多少;生成2mol氨气放热92.2KJ,分解2mol氨气吸热92.2KJ,据等效平衡原理判断分解氨气的物质的量计算吸热多少.
解答 解:(1)氢气是反应物,其物质的量减少,且其减少量与氮气之比为3:1,可以判断Ⅲ为氢气,故答案为:Ⅲ;
(2)t2时刻氢气和氨气的物质的量相等,反应未达到平衡状态,
A、反应未达到平衡状态,故A错误;
B、t2时刻氢气和氨气的物质的量相等,反应速率不同,故B错误;
C、各物质反应速率之比始终大于化学计量数之比,故C正确;
D、t2时刻氢气和氨气的物质的量相等,故D正确;
故答案为:CD;
(3)合成氨开始后,正反应速率逐渐减小,逆反应速率逐渐增大,到平衡后,正逆反应速率相等,正反应速率最小,逆反应速率增大,
故答案为:g;f;
(4)合成氨是反应放热,温度改变后,n(H2)比图象中的值大,说明平衡逆向移动,温度升高平衡逆向移动,温度高于500K,
故答案为:A;
(5)参加反应的氮气的物质的量为90%×2mol=1.8mol,放热1.8mol×92.2KJ/mol=165.96KJ;在相同容器中充入2mol N2和6mol H2与充入4mol NH3达到平衡状态后,各物质浓度相同,充入2mol N2和6mol H2时,平衡后氮气有0.2mol,氢气有0.6mol、氨气有3.6mol,则加入4mol氨气,只反应0.4mol,生成2mol氨气放热92.2KJ,分解2mol氨气吸热92.2KJ,负极0.4mol氨气吸热0.4mol×$\frac{92.2KJ}{2}$=18.44KJ,
故答案为:165.96;吸收;18.44.
点评 本题考查了据图象判断反应物和生成物、平衡状态判断、反应速率与平衡的关系、反应热的计算,题目难度较大.

| A. | 硝酸钾 | B. | 氨水 | C. | 酒精 | D. | 铜 |
| A. | 乙醇(水):加入足量生石灰充分振荡,蒸馏,收集馏出物 | |
| B. | 乙烷(乙烯):通过盛有足量酸性KMnO4溶液的洗气瓶洗气 | |
| C. | CCl4(乙醇):多次加水,振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
| A. | 向醋酸钠水溶液中通入少量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| B. | 向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2═2Mn2++5O2↑+8H2O |
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
| A. | (V1+V2+V3)L | B. | (V1+V2-V3)L | C. | (V1+V2-2V3)L | D. | V3-(V1+V2)L |
| A. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| B. | 以CO和O2构成的碱性燃料电池负极反应式为CO+4OH--2e-═CO32-+2H2O | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | 工业上通过电解氯化钠溶液制备金属钠和氯气 |
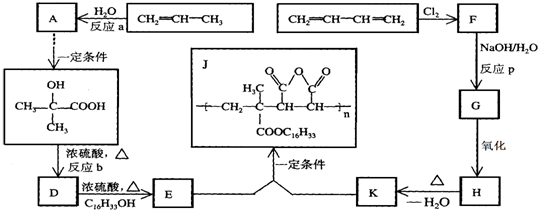
 +H2O
+H2O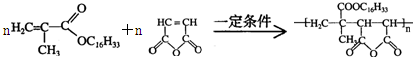 ;
;