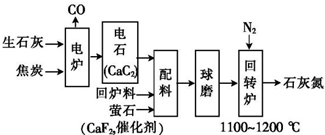
题目内容
14.一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物A,取n g混合物A进行下列操作: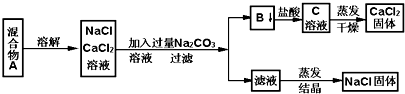
填空和回答下列问题
(1)物质B的电离方程式为CaCO3(熔融)═Ca2++CO32-.
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计不严谨,这一步的正确设计方案应是蒸发结晶操作前,向滤液中逐滴滴加稀盐酸至不产生气体.
(3)假设物质B经过滤、洗涤、干燥后称量,质量为mg.则该样品中NaCl的质量为(n-1.11m).
分析 (1)在NaCl和CaCl2两种固体溶解后的混合溶液里,滴中碳酸钠溶液,生成碳酸钙沉淀,碳酸钙是电解质,在熔融状态下能够发生电离;
(2)除去CaCl2时滴加碳酸钠过量,滤液中的物质有氯化钠和碳酸钠,导致结果得到的氯化钠不纯,因此要得到纯净的氯化钠就需要除去碳酸钠,选择滴加稀盐酸最合适,碳酸钠和稀盐酸生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠;
(3)物质B为碳酸钙,可根据碳酸钙的质量结合原子守恒可求算出CaCl2的质量,从而得到氯化钠的质量.
解答 解:(1)NaCl和CaCl2两种固体混合物,加水溶解后所得溶液里滴加碳酸钠溶液,因Ca2++CO32-=CaCO3↓,故所得固体B为碳酸钙,碳酸钙是电解质,在熔融状态下能电离出Ca2+和CO32-,电离方程式为CaCO3(熔融)═Ca2++CO32-,故答案为:CaCO3(熔融)═Ca2++CO32-;
(2)因碳酸钠过量,滤液中的溶质有氯化钠和碳酸钠,若要得到纯净的氯化钠就需要除去碳酸钠,可向滤液中加入适量盐酸至不产生气体,将多余的碳酸钠全部转化为氯化钠,蒸发后得到纯净的氯化钠,故答案为:蒸发结晶操作前,向滤液中逐滴滴加稀盐酸至不产生气体;
(3)mg碳酸钙的物质的量为$\frac{mg}{100g/mol}=0.01mmol$,根据钙原子守恒可知CaCl2的物质的量也为0.01mmol,质量为$0.01mmol×111g/mol=1.11m\\;g$g,样品中氯化钠的质量为(n-1.11m)g,故答案为:(n-1.11m)g.
点评 考查混合物的分离提纯,涉及电解质的电离、实验方案的设计及数据处理等,中等难度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.关于如图所示的原电池,下列说法正确的是( )
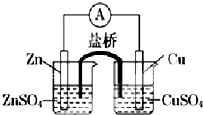

| A. | 电子沿着盐桥从锌电极流向铜电极 | |
| B. | 盐桥中的阳离子向硫酸铜溶液中迁移 | |
| C. | 电流从锌电极通过电流计流向铜电极 | |
| D. | 铜电极上发生的电极反应是2H++2e-═H2↑ |
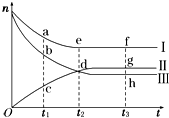 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.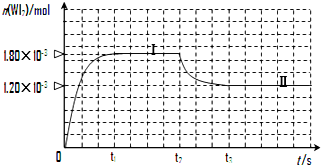 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)