题目内容
下列变化过程中,ΔS<0的是 ( )
| A.氯化钠溶于水中 | B.NH3(g)和HCl(g)反应生成NH4Cl(s) |
| C.干冰的升华 | D.CaCO3(s)分解为CaO(s)和CO2(g) |
B
解析试题分析:A、氯化钠溶于水中变化过程中固体溶解到水中形成溶液,熵值增大,△S>0,故A错误;B、NH3(g)与HCl(g)反应生成NH4Cl(s),熵值减小,△S<0,故B正确;C、干冰升华变化过程中固体变化为气体,熵值增大,△S>0,故C错误;D、CaCO3(s)分解为CaO(s)和CO2(g),熵值增大,△S>0,故D错误。
考点:反应热和焓变

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
对于在一定条件下进行的化学反应:2SO2 + O2  2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是
| A.降低温度 | B.增大压强 | C.使用催化剂 | D.增大反应物浓度 |
从下列事实所得出的解释或结论正确的是
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g) 4NO2(g)+O2(g) ΔH>0 4NO2(g)+O2(g) ΔH>0在室温下能自发进行 | 这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是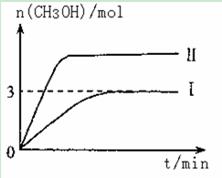
| A.曲线II对应的条件改变是减小压强 |
| B.若T2°C时上述反应的平衡常数为0.42,则T2< T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
| D.在T10C,若起始时向容器中通入4 .5 molCO2、6mol H2 ,平衡时容器内的压强P1=P/2 |
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法。 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)  ?nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
?nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| 容器体积/L 温度/℃ c(Y)/mol·L-1 | 1 L | 2 L | 4 L |
| 100℃ | 1.00 | 0.75 | 0.53 |
| 200℃ | 1.20 | 0.90 | 0.63 |
| 300℃ | 1.30 | 1.00 | 0.70 |
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
决定化学反应速率快慢的根本因素是
| A.温度和压强 |
| B.反应物的浓度 |
| C.参加反应的各物质的性质 |
| D.催化剂的加入 |
反应2SO2(g)+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
| A.0.1s | B.2.5s | C.10s | D.5s |
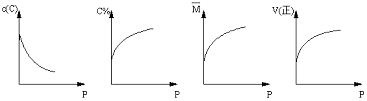
 xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是