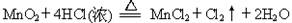题目内容
若(NH4)2SO4加强热分解的产物是SO2、N2、NH3和H2O,则对该反应的下列说法中正确的是( )
| A.化学方程式中产物分子的化学计量数由小到大的顺序是SO2、N2、NH3、H2O |
| B.氧化产物和还原产物的物质的量之比为3∶1 |
| C.被氧化元素原子和被还原元素原子的物质的量之比为2∶3 |
| D.若反应生成1 mol H2O,则转移的电子为6 mol |
C
NH4+→N2,氮元素化合价升高,发生氧化反应,SO42—→SO2,硫元素化合价降低,发生还原反应,首先根据电子守恒配SO2和N2的化学计量数,再用观察法配平反应方程式,可得3(NH4)2SO4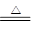 3SO2↑+N2↑+4NH3↑+6H2O。化学计量数由小到大的顺序是N2、SO2、NH3、H2O,A项错误;氧化产物与还原产物的物质的量之比为1∶3,B项错误;被氧化元素原子和被还原元素原子的物质的量之比为2∶3,C项正确;若反应生成1 mol H2O,则转移的电子为1 mol,D项错误
3SO2↑+N2↑+4NH3↑+6H2O。化学计量数由小到大的顺序是N2、SO2、NH3、H2O,A项错误;氧化产物与还原产物的物质的量之比为1∶3,B项错误;被氧化元素原子和被还原元素原子的物质的量之比为2∶3,C项正确;若反应生成1 mol H2O,则转移的电子为1 mol,D项错误
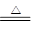 3SO2↑+N2↑+4NH3↑+6H2O。化学计量数由小到大的顺序是N2、SO2、NH3、H2O,A项错误;氧化产物与还原产物的物质的量之比为1∶3,B项错误;被氧化元素原子和被还原元素原子的物质的量之比为2∶3,C项正确;若反应生成1 mol H2O,则转移的电子为1 mol,D项错误
3SO2↑+N2↑+4NH3↑+6H2O。化学计量数由小到大的顺序是N2、SO2、NH3、H2O,A项错误;氧化产物与还原产物的物质的量之比为1∶3,B项错误;被氧化元素原子和被还原元素原子的物质的量之比为2∶3,C项正确;若反应生成1 mol H2O,则转移的电子为1 mol,D项错误
练习册系列答案
相关题目
 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。 6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。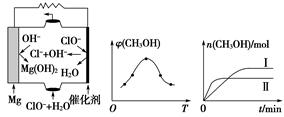
 CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。 +O2↑。下列对此反应的说法中,不正确的是( )
+O2↑。下列对此反应的说法中,不正确的是( )