题目内容
为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g。若硝酸的还原产物只有NO,下列说法正确的是
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |
CD
试题分析:铁的金属性强于铜的,所以硝酸首先氧化金属铁,第一次反应后金属过量,硝酸不足,说明生成物一定有硝酸亚铁。加入稀硫酸后金属又溶解了7.48g-6.60g=0.88g,硫酸中氢离子的物质的量是0.05L×0.4mol/L×2=0.04mol,则根据方程式3M+2NO3-+8H+=3M2++2NO↑+4H2O可知,NO的物质的量是0.01mol,参加反应的金属的物质的量是(0.04mol÷8)×3=0.015mol,则M的相对原子质量是0.88÷0.015=58.67,这说明溶解的金属是铁和铜,所以剩余的7.84g金属是铁和铜的混合物,因此第一次溶解的金属铁是10.00g-7.48g=2.52g,物质的量是2.52g÷56g/mol=0.045mol,6.60g全部是金属铜。硝酸的物质的量是0.2L×0.6mol/L=0.12mol,根据方程式3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,生成物硝酸亚铁的物质的量是0.045mol,NO的物质的量是0.03mol,因此共放出NO是0.04mol。设第二次消耗金属铁和铜的物质的量分别是x和y,则56x+64y=0.88、2x+2y=0.01×3,解得x=0.01mol、y=0.005mol,所以合金中铜的质量是6.60g+0.005mol×64g/mol=6.92g,所以该合金中铜的质量分数为69.2%,答案选CD。

练习册系列答案
相关题目
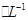
 2H2↑+O2↑,下列有关判断正确的是
2H2↑+O2↑,下列有关判断正确的是 CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
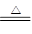 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。