题目内容
【题目】室温时,向20 mL 0.100 0 mol·L-1 H2C2O4溶液中滴加0.100 0 mol·L-1 NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化关系如图所示。下列有关叙述错误的是
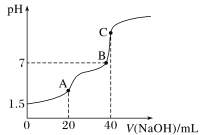
A. 忽略H2C2O4的第二步电离,由题给信息,可以计算出常温下H2C2O4的电离常数
B. A、B、C三点所对应的溶液中,水的电离程度最小的是A点
C. A、B、C三点所对应的溶液中,均有c(Na+)<c(OH-)+c(HC2O4-)+2c(C2O42-)
D. 在B点溶液中,生成的含钠化合物有两种,且c(HC2O4-)+2c(C2O42-)=0.100 0 mol·L-1
【答案】D
【解析】
室温时,向20mL0.1000mol·L-1H2C2O4溶液中滴加0.1000mol·L-1NaOH溶液,发生反应为:H2C2O4+OH-=HC2O4-+H2O,HC2O4-+OH-=C2O42-+H2O,消耗20mLNaOH溶液时为第一化学计量点,恰好生成NaHC2O4,消耗40mLNaOH溶液时为第二化学计量点,恰好生成Na2C2O4。
A.忽略H2C2O4的第二步电离,则H2C2O4存在电离平衡:H2C2O4HC2O4-+H+,起始时,0.1000mol·L-1的草酸溶液的pH为1.5,溶液中c(H+)=c(HC2O4-)=10-1.5mol/L,c(H2C2O4)=0.1mol/L-10-1.5mol/L,则草酸的电离平衡常数为Ka=![]() =
=![]() =0.015,可以计算出常温下H2C2O4的电离常数,故A正确;
=0.015,可以计算出常温下H2C2O4的电离常数,故A正确;
B.酸或碱存在抑制水的电离,盐类水解促进水的电离,随着滴定反应的进行,溶液中H2C2O4的量越来越少。盐类含量越来越高,则水的电离程度逐渐增大,A、B、C三点所对应的溶液中,水的电离程度最小的是A点,故B正确;
C.A、B、C三点所对应的溶液中,均有c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),左边去掉c(H+),可得c(Na+)<c(OH-)+c(HC2O4-)+2c(C2O42-),故C正确;
D.在B点由物料守恒可得:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1000mol·L-1,故D错误。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案