题目内容
LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125 ℃分解为LiH、H2和Al。下列叙述错误的是( )。
| A.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
| B.LiAlH4与D2O反应,所得氢气的摩尔质量为4 g·mol-1 |
| C.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| D.LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O=Al(OH)3+LiOH+4H2↑ |
B
解析

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列应用不涉及氧化还原反应的是
| A.工业上利用N2和H2合成氨,实现人工固氮 |
| B.实验室用NH4Cl和Ca(OH)2制备NH3 |
| C.用FeCl3溶液作为“腐蚀液”刻蚀电路铜板 |
| D.用Na2O2作潜水艇的供氧剂 |
制备食用碘盐(KIO3)原理之一为:I2+2KClO3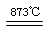 Cl2+2KIO3,下列说法正确的是
Cl2+2KIO3,下列说法正确的是
| A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>CI |
| C.KClO3和KIO3均属于离子化合物,都只含有离子键 |
| D.制备KIO3的反应中氯元素被还原 |
对于铝热反应:Fe2O3 + 2Al 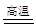 2Fe + Al2O3,下列说法中正确的是( )
2Fe + Al2O3,下列说法中正确的是( )
| A.Fe元素的化合价升高 | B.若27 g Al参加反应则有3 mol电子转移 |
| C.Fe2O3发生氧化反应 | D.Al被还原 |
将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140 mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是
| A.5 mol/L | B.7 mol/L | C.10 mol/L | D.12 mol/L |
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是( )
| A.NaClO溶液的消毒原理是使蛋白质变性 |
| B.1 mol Cl2与足量NaOH溶液反应转移2 mol电子 |
| C.NaClO溶液的漂白原理与Na2O2相同,与SO2不同 |
| D.“84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气 |
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25 mL 0.1 mol/L Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O32-将转化为( )
| A.SO42- | B.SO32- | C.S | D.S2- |
在一种酸性溶液中,可能存在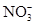 、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是( )
、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是( )
| A.一定有碘离子 | B.可能含铁离子 |
| C.可能有氯离子 | D.不含硝酸根离子 |
爆竹的主要成分为硫黄、炭粉和硝酸钾,为了一些特殊效果还加入镁粉、铁粉、铝粉、锑粉及无机盐。下列说法中不正确的是( )
| A.爆竹爆炸不宜使用水来灭火,可用干沙 |
| B.爆竹的燃放产生大量污染气体,应加以限制 |
| C.爆竹燃放过程中硝酸钾作氧化剂 |
D.爆竹爆炸过程中发生反应为2KNO3+3C+S K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值) K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值) |