题目内容
【题目】为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成分SO2)来制取石膏(CaSO42H2O)和过二硫酸钠(Na2S2O8)。设计简要流程如图:
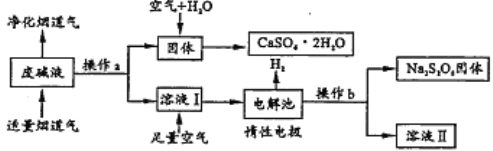
(1)烟道气中SO2与废碱生成沉淀的化学方程式为_____;操作a的名称是_____。
(2)生成CaSO42H2O过程中没有涉及到的化学反应类型为_____(填序号)。
A.复分解反应 B.化合反应 C.分解反应 D.氧化反应 E.置换反应
(3)溶液Ⅰ通入空气发生反应的化学方程式为_____。
(4)用惰性电极电解时,阳极生成Na2S2O8的电极反应为_____;在整个流程中可以循环利用的物质是H2O和_____(填化学式)。
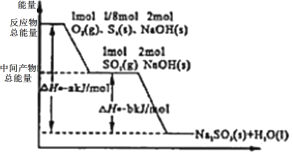
(5)一定条件下将S8(s)、O2(g)、NaOH(s)转化过程中的能量关系用如图简单表示。则S8(s)燃烧的热化学反应方程式为_____。
(6)若制取ag Na2S2O8时,阳极有bL氧气(标况)产生。则电解生成的H2体积在标准状况下为_____L。
【答案】 Ca(OH)2+SO2=CaSO3↓+H2O 过滤 CE .2Na2SO3+O2=2Na2SO4 2SO42--2e-=S2O82- NaOH .S8(s)+8O2(g)=8SO2(g)H=-8(a-b)kJ/mol ![]()
【解析】(1)SO2为酸性氧化物,与碱反应生成盐和水,工业废碱液中含有Ca(OH)2和NaOH,故烟道气中SO2与废碱生成沉淀的化学方程式为:Ca(OH)2+SO2=CaSO3↓+H2O;操作a为分离固体和溶液,故操作a的名称是:过滤。
(2)生成CaSO42H2O过程中涉及的反应有Ca(OH)2+SO2=CaSO3↓+H2O,2CaSO3+O2=2CaSO4,CaSO4+2H2O=CaSO42H2O,涉及复分解反应、氧化还原反应、化合反应,不涉及分解反应和置换反应,故选CE。
(3)溶液I中含Na2SO3,通入空气发生氧化还原反应生成Na2SO4,化学方程式为:2Na2SO3+O2=2Na2SO4。
(4)用惰性电极电解Na2SO4溶液时,若阳极生成Na2S2O8,则可推出,阴离子SO42-在阳极失电子被氧化成S2O82-,电极反应为:2SO42--2e-=S2O82-;阴极是氢离子放电产生氢气,溶液中氢氧根离子浓度增大,经过操作b(蒸发浓缩、冷却结晶),析出Na2S2O8固体后过滤得到溶液Ⅱ,溶液Ⅱ主要为氢氧化钠溶液,可循环使用。
(5)根据能量变化示意图可得热反应方程式:①![]() S8(s)+O2(g)+2NaOH(s)=Na2SO3(s)+H2O(l) △H=-akJ/mol,②SO2(g)+2NaOH(s)=Na2SO3(s)+H2O(l) △H=-bkJ/mol,根据盖斯定律:(①-②)×8得到:S8(s)+8O2(g)=8SO2(g) △H=-8(a-b)kJ/mol。
S8(s)+O2(g)+2NaOH(s)=Na2SO3(s)+H2O(l) △H=-akJ/mol,②SO2(g)+2NaOH(s)=Na2SO3(s)+H2O(l) △H=-bkJ/mol,根据盖斯定律:(①-②)×8得到:S8(s)+8O2(g)=8SO2(g) △H=-8(a-b)kJ/mol。
(6)根据电极反应式:2SO42--2e-=S2O82-可知,制取agNa2S2O8,失去电子的物质的量为:2×ag÷238g/mol;因为阳极有bL标准状况的氧气产生,说明电解后期氢氧根离子在阳极放电产生氧气,根据关系O2~4e-,后期失电子的物质的量为:4×bL÷22.4L/mol,则在阳极失电子总物质的量为: ![]() +
+![]() ,电解过程中氢离在阴极得电子生成氢气,关系式为:H2~2e-,根据得失电子守恒,阴极产生氢气的物质的量为:(
,电解过程中氢离在阴极得电子生成氢气,关系式为:H2~2e-,根据得失电子守恒,阴极产生氢气的物质的量为:(![]() +
+![]() )÷2=
)÷2=![]() +
+![]() ,则电解生成的H2在标准状况下体积为:(
,则电解生成的H2在标准状况下体积为:(![]() +
+![]() )×22.4L/mol=(
)×22.4L/mol=(![]() )mol。
)mol。

 53随堂测系列答案
53随堂测系列答案