题目内容
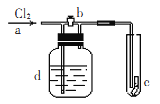
【题目】下图是实验室进行氯气的制备及性质实验的组合装置,部分固定装置未画出。
(1)A中固体是氯酸钾,液体a是浓盐酸,写出该反应的化学方程式:。
(2)B为干燥装置,加入的固体是;欲净化氯气,A、B间应添加一个盛有的洗气瓶。
(3)C中的反应现象是;D的作用是。
(4)已知E中发生的反应为:Cl2+Na2SO3+2NaOH ![]() 2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
a.甲同学认为该吸收液中ClO-和SO32-不能同时存在,其理由是(用离子方程式表示)。
b.乙同学为了检验吸收液中是否含有SO32- , 取少量吸收液于试管中,加适量稀硫酸酸化后,滴加品红溶液,发现品红溶液褪色。据此推断该吸收液中一定有SO32-。乙同学的推断是否正确?(填“正确”或“不正确”),理由是。
c.请设计实验检验吸收液中是否含有ClO-(写出实验步骤、现象和结论)。
【答案】
(1)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(2)五氧化二磷;饱和食盐水
(3)生成棕黄色的烟;安全瓶
(4)ClO-+SO32-=Cl-+SO42-;不正确;HClO具有漂白性,也能使品红溶液褪色取少量吸收液,加入适量稀硫酸酸化,再加入几滴石蕊溶液,若溶液先变红后褪色,则原溶液中含有ClO-;若溶液变红且不褪色,则原溶液中不含ClO-
【解析】(1)固体氯酸钾与浓盐酸混合可生成氯化钾和氯气,根据电子守恒和原子守恒,发生反应的化学方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
(2)浓盐酸具有挥发性,制备的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择盛有饱和食盐水洗气瓶除去氯化氢,五氧化二磷为酸性干燥剂,与氯气不反应,可以干燥氯气;
(3)在加热条件下Cu遇氯气,剧烈燃烧,产生棕黄色的烟;因氯气易溶于NaOH溶液,为防止产生倒吸现象,选择D装置作安全瓶;
(4)a.因ClO-有强氧化性,而SO32-有较强还原性,二者易发生反应ClO-+SO32-=Cl-+SO42- , 则吸收液中不可能同时存在ClO-和SO32-;
b.因吸收液中可能存在ClO- , 在酸性条件下HClO有漂白性,也能使品红褪色,故乙同学的推断不正确;
c.为检验吸收液中是否含有ClO- , 可取少量吸收液,加入适量稀硫酸酸化,再加入几滴石蕊溶液,若溶液先变红后褪色,则原溶液中含有ClO-;若溶液变红且不褪色,则原溶液中不含ClO-。
【考点精析】认真审题,首先需要了解氯气的化学性质(氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应),还要掌握氯气的实验室制法(实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O)的相关知识才是答题的关键.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案