题目内容
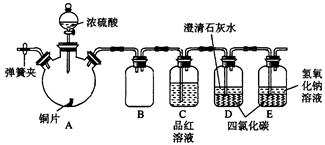
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。请回答下列问题:

(1)通过试管乙中发生的 现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有 性。
(2)若要收集试管甲中生成的气体,可以采用 收集方法。
①排水取气法 ②向上排空气取气法 ③向下排空气取气法
(3)写出试管甲中所发生反应的化学反应方程式 。
(4)试管乙口部浸有碱液的棉花的作用是 ,
此防范措施也说明产生的气体是 气体(填“酸性”、“中性”或“碱性”)。

(1)通过试管乙中发生的 现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有 性。
(2)若要收集试管甲中生成的气体,可以采用 收集方法。
①排水取气法 ②向上排空气取气法 ③向下排空气取气法
(3)写出试管甲中所发生反应的化学反应方程式 。
(4)试管乙口部浸有碱液的棉花的作用是 ,
此防范措施也说明产生的气体是 气体(填“酸性”、“中性”或“碱性”)。
(1)品红溶液 漂白性 (2)②
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)吸收产生的SO2气体 防止污染环境 酸性
(3)Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O(4)吸收产生的SO2气体 防止污染环境 酸性
(1)SO2检验漂白性,能使品红溶液褪色,据此可以说明铜和浓硫酸发生了化学反应。
(2)SO2易溶于水,但密度大于空气的,所以可用向上排空气法收集,答案选②。
(3)方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)SO2是一种大气污染物,同时也是一种酸性气体,可用碱液吸收。
(2)SO2易溶于水,但密度大于空气的,所以可用向上排空气法收集,答案选②。
(3)方程式为Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。(4)SO2是一种大气污染物,同时也是一种酸性气体,可用碱液吸收。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目