题目内容
【题目】某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:

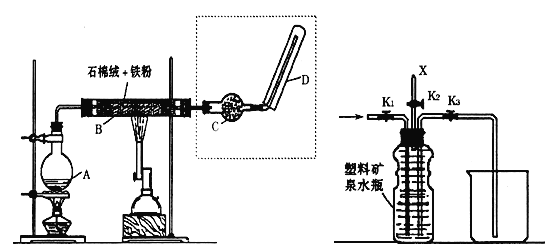
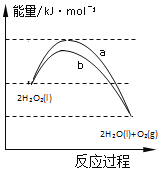
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为___;实验过程中,装置B中观察到的现象是______;装置C中有白色沉淀生成,该沉淀是_____(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:______。
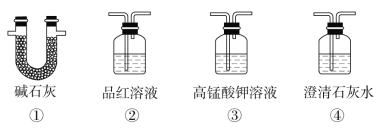
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为____(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是___。
(4)某同学发现实验后期装置A中产生的气体中还含有H2,理由是___________ (用离子方程式表示)。
【答案】分液漏斗 品红试纸褪色,石蕊试纸变红 BaSO4 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O ③②④ 赶尽装置中的空气,防止空气中的CO2影响实验 Fe+2H+=Fe2++H2↑
CO2↑+2SO2↑+2H2O ③②④ 赶尽装置中的空气,防止空气中的CO2影响实验 Fe+2H+=Fe2++H2↑
【解析】
(1)根据装置图,结合常见仪器的形状分子判断仪器b的名称,生铁(含碳)与浓硫酸反应生成二氧化硫,二氧化硫的水溶液具有漂白性和酸性,据此分析解答装置B中观察到的现象;硝酸具有强氧化性,能够将二氧化硫氧化生成硫酸,据此分析判断;
(2)生铁中的碳能够与浓硫酸反应生成二氧化碳、二氧化硫与水;
(3)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,需要先将二氧化硫完全除去,才能检验二氧化碳;装置有空气,空气中也含有二氧化碳,据此分析解答;
(4)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气。
(1)由装置图可知,仪器b为分液漏斗,生铁(含碳)与浓硫酸反应生成二氧化硫,二氧化硫的水溶液具有漂白性和酸性,可使湿润的品红试纸褪色,使湿润的蓝色石蕊试纸变红;硝酸具有强氧化性,把二氧化硫氧化为硫酸根离子,所以二氧化硫通入硝酸钡溶液,会生成硫酸钡白色沉淀,故答案为:分液漏斗;品红试纸褪色,石蕊试纸变红;BaSO4;
(2)生铁中的碳能够与浓硫酸反应生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(3)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,从左到右的顺序为③②④;由于装置有空气,空气中含有二氧化碳,多次鼓入氮气,可以排尽装置中的空气,防止空气中的CO2影响实验,故答案为:③②④;赶尽装置中的空气,防止空气中的CO2影响实验;
(4)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气,反应离子方程式为:Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,按要求用化学式或化学用语填空,用序号填写不得分。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为_____________;
(2)地壳中含量最多的非金属元素是_____________;
(3)与水反应最剧烈的金属单质是_____________;
(4)某元素三价阳离子的核外有10个电子,该元素是_____________;
(5)气态氢化物最稳定的化合物是_____________;
(6)①的最高价氧化物的电子式为_____________;
(7)用电子式表示④和⑨形成化合物的过程_____________。
(8)最高价氧化物对应的水化物碱性最强的化合物是_____________;元素的最高价氧化物对应的水化物中具有两性的化合物是_____________;两者反应的离子方程式为_____________。