题目内容
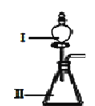
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
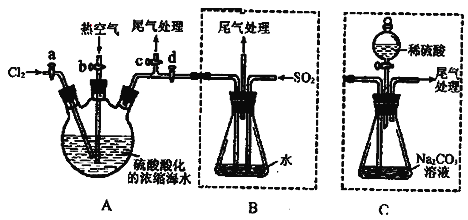
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入氯气至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)工业上采用电解饱和食盐水的方法来制备氯气,该反应的化学方程式为______________________________________________________________________;
(2)步骤②中鼓入热空气的作用为___________________________________;此实验中尾气可用_____(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(3)步骤③中发生的主要反应的离子方程式为______________________________。
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBr、NaBrO3等,该反应的化学方程式为___________________________________。
(5)与B装置相比,采用C装置的优点为________________,__________________________。
【答案】2NaCl + 2H2O![]() 2 NaOH + H2↑+ Cl2↑ 使A中生成的Br2随空气流进入B中 c
2 NaOH + H2↑+ Cl2↑ 使A中生成的Br2随空气流进入B中 c
Br2+SO2+2H2O=4H++2Br+SO42 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ 操作简单 污染小
【解析】
(1)工业上采用电解饱和食盐水的方法来制备氯气,同时还生成氢氧化钠和氢气;
(2)溴易挥发,热空气可使溴蒸气进入B中;尾气含SO2、Br2,均与碱溶液反应;
(3)步骤③中,向B中通入足量SO2,与溴发生氧化还原反应生成硫酸、HBr;
(4)C中反应生成了NaBrO3,可知Br元素的化合价升高,则还应生成NaBr;
(5)C比B更容易操作,尾气处理效果好.
(1)工业上采用电解饱和食盐水的方法来制备氯气,还生成氢氧化钠和氢气,该反应的化学方程式为2NaCl + 2H2O![]() 2 NaOH + H2↑+ Cl2↑;
2 NaOH + H2↑+ Cl2↑;
故答案为:2NaCl + 2H2O![]() 2 NaOH + H2↑+ Cl2↑;
2 NaOH + H2↑+ Cl2↑;
(2)步骤②中鼓入热空气的作用为使A中生成的Br2随空气流进入B中,尾气含SO2、Br2,均与碱溶液反应,则选NaOH溶液吸收尾气;
故答案为:使A中生成的Br2随空气流进入B中;C;
(3)步骤③中发生的主要反应的离子方程式为Br2+SO2+2H2O=4H++2Br+SO42;
故答案为:Br2+SO2+2H2O=4H++2Br+SO42;
(4)C中反应生成了NaBrO3,可知Br元素的化合价升高,则还应生成NaBr,且酸与碳酸钠反应生成二氧化碳,该反应为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;
故答案为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;
(5)与B装置相比,采用C装置的优点为C装置的优点为操作简单、污染小;
故答案为:操作简单;污染小。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案