题目内容
【题目】一种利用电化学方法同时脱除NO/SO2的工艺如图所示:
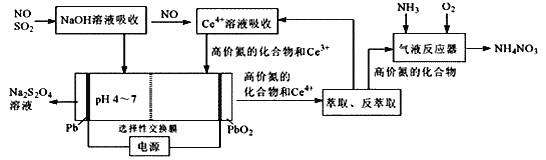
已知SO2水溶液中含硫微粒分布分数(Xi)与pH关系如图所示
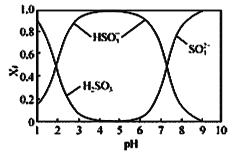
(1)NaOH溶液吸收SO2时,溶液的pH由9→6时,主要发生反应的离子方程式为________。
(2)含Ce4+的溶液吸收NO,若高价氮中的NO2、N2O3、NO2-、NO3-各1mol,则消耗0.5mol·L-1的含Ce4+溶液的体积为________L;其中NO转化NO3-的离子方程式为________。
(3)电解槽中,阴极电极反应式主要为________,阳极电极反应式为________。
(4)在“气液反应器”中高价氮中的N2O3化合为NH4NO3的化学方程式为________。
【答案】SO32-+SO2+H2O=2HSO3- 16 3Ce4++NO+2H2O=3Ce3++NO3-+4H+ 2HSO3-+2H++2e-=S2O42-+2H2O Ce3+-e-=Ce4+ N2O3+H2O+O2+2NH3=2NH4NO3
【解析】
(1)根据SO2水溶液中含硫微粒分布分数图写出反应的离子方程式;
(2)根据得失电子守恒计算消耗含Ce4+溶液的体积;根据得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
(3)电解过程中,阴极上HSO3-发生得电子的还原反应生成S2O42-,阳极上Ce3+发生失电子的氧化反应生成Ce4+,据此写出电极反应式;
(4)根据流程信息确定反应物和生成物,结合得失电子守恒、原子守恒书写反应的化学方程式。
(1) 根据SO2水溶液中含硫微粒分布分数图可知,溶液的pH由9→6的过程中,SO32-在减少,HSO3-在增多,故反应的离子方程式为SO32-+SO2+H2O=2HSO3-;
(2)含Ce4+的溶液吸收NO的过程中,Ce4+被还原为Ce3+,NO转化为高价氮中的NO2、N2O3、NO2-和NO3-,反应过程中得失电子守恒,因此可得n(Ce4+)×1=1mol×2+1mol×2+1mol×1+1mol×3,因此n(Ce4+)=8mol,因此所需0.5mol/L的含Ce4+溶液的体积![]() ;Ce4+将NO氧化为NO3- ,自身还原为Ce3+;反应过程中,Ce由+4价变为+3价,得到1个电子,N由+2价变为+5价,失去3个电子,根据得失电子守恒可得,Ce4+、Ce3+的系数为3,NO和NO3-的系数为1;根据电荷守恒可得生成物中含有H+, 且其系数为4;根据氢原子个数守恒可得反应物中含有H2O,且其系数为2;因此可得该反应的离子方程式为: 3Ce4++NO+2H2O=3Ce3++NO3-+4H+;
;Ce4+将NO氧化为NO3- ,自身还原为Ce3+;反应过程中,Ce由+4价变为+3价,得到1个电子,N由+2价变为+5价,失去3个电子,根据得失电子守恒可得,Ce4+、Ce3+的系数为3,NO和NO3-的系数为1;根据电荷守恒可得生成物中含有H+, 且其系数为4;根据氢原子个数守恒可得反应物中含有H2O,且其系数为2;因此可得该反应的离子方程式为: 3Ce4++NO+2H2O=3Ce3++NO3-+4H+;
(3)电解过程中,HSO3-在阴极发生得电子的还原反应,生成S2O42-, 其电极反应式为: 2HSO3-+2H++2e-=S2O42-+2H2O;Ce3+在阳极发生失电子的氧化反应,生成Ce4+, 其电极反应式为:Ce3+-e-=Ce4+;
(4)在“气液反应器”中,反应物为N2O3、NH3和O2, 生成物为NH4NO3, 根据得失电子守恒、原子守恒可得该反应的化学方程式为:N2O3+H2O+O2+2NH3=2NH4NO3。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小