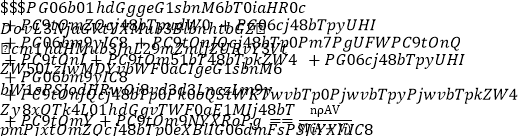ЬтФПФкШн
ЁОЬтФПЁПШчЭМЪЧдЊЫижмЦкБэжаЕФЧАЫФжмЦкЃЌЂйЁЋЂсЮЊЯргІЕФдЊЫиЃЌЧыДгжабЁдёКЯЪЪЕФдЊЫиЛиД№ЮЪЬтЃК
ЃЈ1ЃЉИљОндЊЫидзгЕФЭтЮЇЕчзгХХВМЬиеїЃЌдЊЫижмЦкБэПЩЛЎЗжЮЊЮхИіЧјгђЃЌЂйдЊЫиЮЛгкжмЦкБэЕФ______________ЧјЁЃ
ЃЈ2ЃЉЂкЁЂЂоСНдЊЫиаЮГЩЕФЛЏКЯЮяЕФПеМфЙЙаЭЮЊ______________ЃЌЦфжааФдзгЕФдгЛЏЙьЕРРраЭЮЊ________ЁЃ
ЃЈ3ЃЉаДГідЊЫиЂлгыдЊЫиЂнаЮГЩЕФЮШЖЈЛЏКЯЮяЕФНсЙЙЪН_______________ЁЃ
ЃЈ4ЃЉЂрЕФЖўМлбєРызггыЙ§СПЕФЂмЕФЧтЛЏЮяЕФЫЎЛЏЮязїгУЕФРызгЗНГЬЪНЮЊЃК______ЁЃ
ЃЈ5ЃЉдЊЫиЂпгыCOПЩаЮГЩX(CO)5аЭЛЏКЯЮяЃЌИУЛЏКЯЮяГЃЮТЯТГЪвКЬЌЃЌШлЕуЮЊЃ20.5 ЁцЃЌЗаЕуЮЊ103 ЁцЃЌвзШмгкЗЧМЋадШмМСЃЌОнДЫПЩХаЖЯИУЛЏКЯЮяОЇЬхЪєгк________ОЇЬхЃЈЬюОЇЬхРраЭЃЉЁЃ
ЃЈ6ЃЉдЊЫиЂсЕФРызгЕФЧтбѕЛЏЮяВЛШмгкЫЎЃЌЕЋПЩШмгкАБЫЎжаЃЌИУРызггыNH3МфНсКЯЕФзїгУСІЮЊ________ЁЃ
ЃЈ7ЃЉН№ЪєЂпЕФОЇЬхдкВЛЭЌЮТЖШЯТгаСНжжЖбЛ§ЗНЪНЃЌОЇАћЗжБ№ШчЭМЫљЪОЁЃдђУцаФСЂЗНОЇАћКЭЬхаФСЂЗНОЇАћжаЪЕМЪКЌгаЕФдзгИіЪ§жЎБШЮЊ________ЁЃ
ЁОД№АИЁПs ЦНУце§Ш§НЧаЮ sp2дгЛЏ OЃНCЃНO Cu2ЃЋЃЋ4NH3ЁЄH2O=[Cu(NH3)4]2ЃЋЃЋ4H2O Зжзг ХфЮЛМќ 2ЁУ1
ЁОНтЮіЁП
ИљОндЊЫижмЦкБэжаЕФЮЛжУЃЌПЩвдЭЦЖЯЂйЮЊHЃЌЂкЮЊBЃЌЂлЮЊCЃЌЂмЮЊNЃЌЂнЮЊOЃЌЂоЮЊFЃЌЂпЮЊFeЃЌЂрCuЃЌЂсZnЁЃ
ЃЈ1ЃЉЂйHдЊЫиЮЛгкI AзхЃЌЪєгкsЧјЃЛ
ЃЈ2ЃЉЂкЂоаЮГЩЕФЛЏКЯЮяЮЊBF3ЃЌЦфПеМфЙЙаЭЮЊЦНУце§Ш§НЧаЮЃЌжааФдзгBЕФЙьЕРдгЛЏРраЭЮЊsp2дгЛЏЃЛ
ЃЈ3ЃЉЂлЂнаЮГЩЕФЮШЖЈЛЏКЯЮяЮЊCO2ЃЌЦфНсЙЙЪНЮЊOЃНCЃНOЃЛ
ЃЈ4ЃЉЂрЕФЖўМлбєРызгЮЊCu2+ЃЌЂмЕФЧтЛЏЮяЕФЫЎЛЏЮяЮЊNH3ЁЄH2O ЃЌСНепЗДгІЕФРызгЗНГЬЪНЮЊЃКCu2ЃЋЃЋ4NH3ЁЄH2O=[Cu(NH3)4]2ЃЋЃЋ4H2OЃЛ
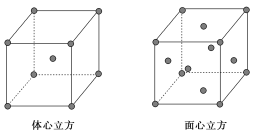
ЃЈ5ЃЉИУЛЏКЯЮяГЃЮТЯТГЪвКЬЌЃЌШлЕуЮЊЃ20.5 ЁцЃЌЗаЕуЮЊ103 ЁцЃЌвзШмгкЗЧМЋадШмМСЃЌдђИУЛЏКЯЮяОЇЬхЪєгкЗжзгОЇЬхЃЛ
ЃЈ6ЃЉЂсЕФРызгЮЊZn2+ЃЌШмгкАБЫЎаЮГЩ[Zn(NH3)4]2ЃЋРызгЃЌZn2+КЭNH3МфНсКЯЕФзїгУСІЮЊХфЮЛМќЃЛ
ЃЈ7ЃЉУцаФСЂЗНОЇАћЫљКЌдзгИіЪ§ЮЊЃК![]() =4ЃЌЬхаФСЂЗНОЇАћЫљКЌдзгИіЪ§ЮЊЃК
=4ЃЌЬхаФСЂЗНОЇАћЫљКЌдзгИіЪ§ЮЊЃК![]() =2ЃЌдђСНжжЖбЛ§ЗНЪНЫљКЌЕФдзгИіЪ§БШЮЊ2ЃК1ЁЃ
=2ЃЌдђСНжжЖбЛ§ЗНЪНЫљКЌЕФдзгИіЪ§БШЮЊ2ЃК1ЁЃ

 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИЁОЬтФПЁПИљОнЯТСаВйзїКЭЯжЯѓЃЌЫљЕУНсТле§ШЗЕФЪЧ
бЁЯю | ЪЕбщВйзїМАЯжЯѓ | ЪЕбщНсТл |
A | Яђ NaClЁЂNaI ЕФЛьКЯЯЁШмвКжаЕЮШыЩйСПЯЁ AgNO3 ШмвКЃЌЯШгаЛЦЩЋГСЕэЩњГЩ | Ksp(AgCl)>Ksp(AgI) |
B | НЋСђЫсЫсЛЏЕФ H2O2 ШмвКЕЮШы Fe(NO3)2 ШмвКжаЃЌШмвКБфЛЦ | жЄУїбѕЛЏадЃКH2O2>Fe3+ |
C | ГЃЮТЯТЃЌгУ pH МЦВтЖЈ 0.1 molЁЄL-1 NaA ШмвКЕФ pH аЁгк 0.1 molЁЄL-1Na2CO3 ШмвКЕФ pH | ФмжЄУїЫсадЃКHA>H2CO3 |
D | ШЁ a g ТСВгызуСПЧтбѕЛЏФЦШмвКГфЗжЗДгІЃЌвнГіЕФЦјЬхЭЈЙ§ХЈСђЫсКѓЃЌВтЦфЬхЛ§ЮЊ V L(БъзМзДПіЯТ) | ВтЖЈТСВжа Al2O3 КЌСП |
A.AB.BC.CD.D