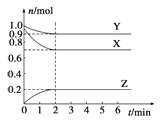
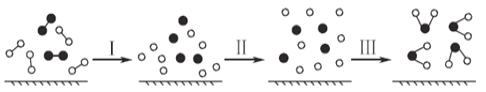
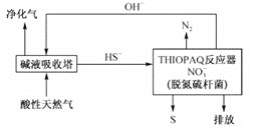
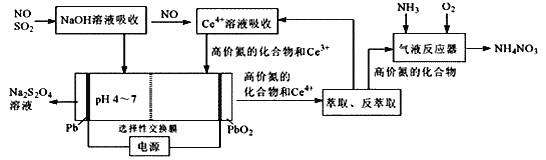
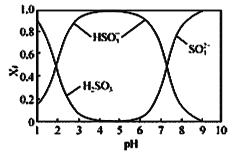
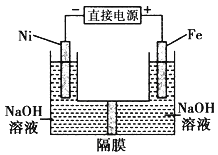
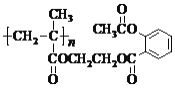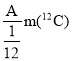题目内容
【题目】(1)密度为1.10 g/mL、质量分数为20%的盐酸的物质的量浓度为__________ mol/L
(2)取此盐酸50 mL和足量的镁反应后,求:
①放出的H2在标准状况下的体积_______________。
②将生成的H2缓慢通过过量的灼热CuO,求理论上被还原出的铜的质量__________
【答案】6.03 3.38 9.64g
【解析】
(1)根据c=![]() 计算出该盐酸的物质的量浓度;
计算出该盐酸的物质的量浓度;
(2)①根据n=cV计算出溶液中含有氯化氢的物质的量,再根据氢原子守恒计算出生成氢气的物质的量,然后根据V=nVm计算出标况下氢气的体积;
②根据H2+CuO=Cu+H2O写出氢气与氧化铜、铜的关系式,然后计算出还原产物的质量。
(1)该盐酸的物质的量浓度为:c=![]() mol/L=6.03mol/L;
mol/L=6.03mol/L;
(2)①50mL 6.03mol/L的该盐酸溶液中含有溶质氯化氢的物质的量为:n(HCl)=6.03mol/L×0.05L=0.3015mol,根据H原子质量守恒定律可知,生成氢气的物质的量为:n(H2)=![]() ×0.3015mol=0.15075mol,标况下0.15075mol氢气的体积为:22.4L/mol×0.15075mol≈3.38L;
×0.3015mol=0.15075mol,标况下0.15075mol氢气的体积为:22.4L/mol×0.15075mol≈3.38L;
②根据H2+CuO=Cu+H2O可得,氢气与氧化铜反应的关系式为:H2~CuO~Cu,则0.15075mol氢气完全反应还原的Cu的物质的量为0.15075mol,0.15075mol铜的质量为:64g/mol×0.15075mol≈9.64g。

【题目】对下表中实验操作或现象的解释不合理的是![]()
实验操作及现象 | 现象的解释 | |
A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
C | 往水中加入 | 产生了碱性物质,且 |
D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
A.AB.BC.CD.D