题目内容
12.文献报道某课题组利用CO2催化氢化制甲烷的研究过程如图1:
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图2所示(仅改变镍粉用量,其他条件不变):研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:CO2$\stackrel{Ⅰ}{→}$HCOOH$\stackrel{Ⅱ}{→}$CH4.由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )
| A. | 反应Ⅰ的速率增加,反应Ⅱ的速率不变 | |
| B. | 反应Ⅰ的速率不变,反应Ⅱ的速率增加 | |
| C. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 | |
| D. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |
分析 Ni为有机反应中常用的加氢催化剂之一,反应I、II均为加氢反应,故加入Ni粉会使反应ⅠⅡ的速率均增加;从图中可见随着镍粉用量从1 mmol增加到10 mmol,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快.
解答 解:由于反应是在固定时间内完成,之后进行冷却和物质检验,因此检验得到的物质产量(mmol)即可以代表化学反应的平均速率,Ni为有机反应中常用的加氢催化剂之一,反应I、II均为加氢反应,故加入Ni粉会使反应ⅠⅡ的速率均增加,在图中表现为CH4的生成速率和H2的消耗速率均增大,从图中可见随着镍粉用量从1 mmol增加到10 mmol,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快,
故选:D.
点评 本题从生活的热点问题出发,探讨了能源的循环利用和温室效应的解决,着重考查了物质催化反应的过程,结合考查了化学反应速率和对图表的理解解析能力,综合能力要求较高.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.如图图示与对应的叙述相符的是( )


| A. | 图甲表示反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
6.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
1.下列微粒中,所有原子都满足最外层为8电子结构的是( )
| A. | 碳正离子[(CH3)3C+] | B. | PCl3 | C. | 尿素( ) ) | D. | HClO |
7.下列说法正确的是( )
| A. | 糖类物质的分子都可以用Cm(H2O)n来表示 | |
| B. | 凡能溶于水具有甜味的物质都属于糖类 | |
| C. | 糖类都能发生水解反应 | |
| D. | 糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物 |
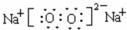 .
.
 某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.
某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.