题目内容
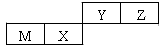
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
| | R | |
| X | T | Z |
| | Q | |
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
BD
F2与H2在暗处剧烈化合并发生爆炸,生成HF,由此推断R为氟;以氟在元素周期表中位置为突破口,由此可以推断X、T、Z、Q分别是硫、氯、氩、溴。Z、T、X分别是氩、氯、硫,稀有气体元素性质很稳定,同周期主族元素的非金属性随原子序数增大而递增,则非金属性:氩<硫<氯或Z<X<T,A项错误;R、Q分别是氟、溴,原子序数分别为9、35,氟和溴元素的原子序数相差35—9=26,由于元素的原子序数=原子的核外电子数,则氟和溴原子的电子数也相差26,B项正确;R、T、Q分别为氟、氯、溴,都是卤素,同主族非金属元素的非金属性随原子序数增大而减弱,则非金属性:氟>氯>溴,非金属性越强,气态氢化物越稳定,则HF>HCl>HBr或R>T>Q,C项错误;T、Q分别是氯、溴,非金属性:氯>溴,非金属性越强,最高价氧化物的水化物酸性越强,则高氯酸(HClO4)的酸性比高溴酸(HBrO4)强或 T>Q,D项正确。
本题考查考生对第VIA、VIIA、0族元素单质和重要化合物性质的了解;考查考生对元素在元素周期表中的位置及其性质递变规律的了解;综合考查考生对“位置、结构、性质”三角关系的掌握程度。同时考查考生简单推理的能力,以及对重要非金属元素及其化合物相关性质的掌握。着重考查卤素及其化合物的结构和主要性质。
本题考查考生对第VIA、VIIA、0族元素单质和重要化合物性质的了解;考查考生对元素在元素周期表中的位置及其性质递变规律的了解;综合考查考生对“位置、结构、性质”三角关系的掌握程度。同时考查考生简单推理的能力,以及对重要非金属元素及其化合物相关性质的掌握。着重考查卤素及其化合物的结构和主要性质。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目