题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。
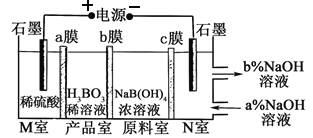
(1)实验室在40℃、pH﹦4的条件下用Na2SO3溶液和SO2反应制取Na2S2O5:Na2SO3+SO2=Na2S2O5实验时先用CO2气体尽可能排除装置内空气的目的是_____________。
(2)若制备19 g Na2S2O5至少需标准状况下SO2_____________L。
(3)为了检验某抗氧化剂产品中Na2S2O5的质量分数,某研究小组进行如下实验:
步骤I:称取抗氧化剂产品0.2 g,将其加入到含I2浓度为0.05000 mol·L1 的100 mL稀盐酸和碘水的混合溶液中,然后加水稀释至500 mL。
步骤II:取稀释后的溶液100 mL,加入几滴淀粉溶液,用0.1000 mol·L1 Na2S2O3标准溶液进行滴定,共消耗Na2S2O3标准溶液12.00 mL(2S2O32- + I2=2I- + S4O62-)。
①写出步骤I中Na2S2O5和I2反应的离子方程式_____________。
②计算抗氧化剂产品中Na2S2O5质量分数,写出计算过程_____________。
【答案】 防止焦亚硫酸钠被氧化 2.24 S2O52- + 2I2 + 3H2O=2SO42-+ 4I- + 6H+ 在500 mL混合溶液中溶解I2的物质的量为:
n(I2) = 0.05000 mol·L1×100 mL×10-3 L·ml1=5.00×10-3 mol
Na2S2O3标准溶液消耗I2物质的量为
2S2O32-+I2=2I-+S4O62-
n(I2) =![]() =6.00×0-4 mol
=6.00×0-4 mol
则在500mL混合溶液中与反应消耗I2物质的量为
n(I2) =5.00×10-3 mol﹣6.00×10-4 mol ×5 =2.00×0-3 mol
n(Na2S2O5) =![]() =1.00×10-3 mol
=1.00×10-3 mol
Na2S2O5的质量分数=![]() ×100%=95%
×100%=95%
【解析】试题分析:(1)Na2S2O5易被氧气氧化。
(2)根据化学方程式计算制备19 g Na2S2O5至少需标准状况下SO2的体积。(3)①Na2S2O5被I2氧化为硫酸钠;
②Na2S2O5和Na2S2O3都与碘单质反应,根据方程式计算抗氧化剂产品中Na2S2O5质量分数。
解析:(1). Na2S2O5易被氧气氧化,为防止焦亚硫酸钠被氧化,先用CO2气体尽可能排除装置内空气 ;
(2)设制备19 g Na2S2O5需标准状况下SO2的体积为VL;
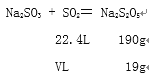
![]() ,V=2.24L
,V=2.24L
(3)①Na2S2O5被I2氧化成硫酸钠,根据电子守恒配平方程式,S2O52- + 2I2 + 3H2O=2SO42-+ 4I- + 6H+ 。
(4). 在500 mL混合溶液中溶解I2的物质的量为:
n(I2) = 0.05000 mol·L1×100 mL×10-3 L·ml1=5.00×10-3 mol
Na2S2O3标准溶液消耗I2物质的量为
2S2O32-+I2=2I-+S4O62-
n(I2) =![]() =6.00×0-4 mol
=6.00×0-4 mol
则在500mL混合溶液中与反应消耗I2物质的量为
n(I2) =5.00×10-3 mol﹣6.00×10-4 mol ×5 =2.00×0-3 mol
n(Na2S2O5) =![]() =1.00×10-3 mol
=1.00×10-3 mol
Na2S2O5的质量分数=![]() ×100%=95%
×100%=95%

【题目】传统医学治疗疟疾时将青蒿加水煮沸,但药效很差。改用乙醇控温60℃提取青蒿素,药效显著提高。屠呦呦用一种更适宜的物质从青蒿中提取青蒿素,这种提取物对疟原虫的抑制率达到了100%,这种适宜的物质是
A | B | C | D | |
物质 | 乙醚 | 四氯化碳 | 丙醇 | 煤油 |
沸点℃ | 34.5 | 76.5 | 97.4 | 180-310 |
A. A B. B C. C D. D