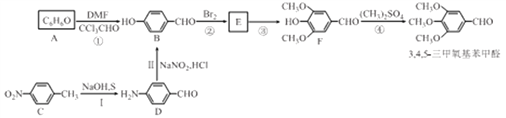
��Ŀ����
����Ŀ��20��ʱ����20 mL 0.1 mol��L-1��Na2CO3��Һ����μ���0.1 mol��L-1����������H2CO3�ķֽ��CO2�Ļӷ�������ҺpH���������������仯������ͼ������˵����ȷ����
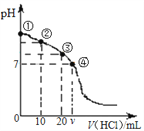
A. �����ʾ��Һ�У�c(CO32��)��c(HCO3��)��c(OH��)��c(H+)
B. �����ʾ��Һ�У�c(CO32��)��c(Cl��)��c(HCO3��)��c(OH��)
C. �����ʾ��Һ�У�c(OH��)��c(H+)��c(H2CO3)��c(CO32��)
D. �����ʾ��Һ�У�c(Cl��)��2c(H2CO3) + c(HCO3��)
���𰸡�CD
�������������̼������Һ��c(CO32��)��c(OH��) ��c(HCO3��)��c(H+)����A�����������20 mL 0.1 mol��L-1��Na2CO3��Һ����μ���10 mL 0.1 mol��L-1���ᣬ��һ���̼��������̼�����ƣ�̼�������ˮ��̶ȴ���̼��������ӣ�����c(HCO3��) ��c(Cl��)��c(CO32��)��c(OH��)����B�����ΪNa2CO3��Һ������ǡ�÷�Ӧ����̼�����ƣ����������غ�c(OH��)��c(H+)��c(H2CO3)��c(CO32��)����C��ȷ�����Ϊ���ԣ����ݵ���غ�c(HCO3��)+2c(CO32��)+c(Cl��)��c(Na+) �����������غ�c(Na+)= 2c(HCO3��)+2c(CO32��)+ 2c(H2CO3)������c(Cl��)��2c(H2CO3) + c(HCO3��)����D��ȷ��

 ��У����ϵ�д�
��У����ϵ�д�