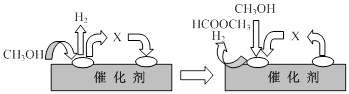
题目内容
(14分)
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
(1)5.0×10-7mol/L (2分) 5.0×10-11mol/L(2分)
(2)c( Na+) > c(CH3COO-) > c( OH-)> c(H+)(2分),
(3)Al3+ + 3H2O  Al(OH)3 + 3H+(2分) Al(OH)3;
Al(OH)3 + 3H+(2分) Al(OH)3;
(4)CH3OH (l)+ O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
(5) H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
(6)2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1 (2分)
或写成2N2H4 (g) + NO2 (g) = N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
解析试题分析:(1)在纯水中存在电离平衡:H2O H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O
H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O  Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+
Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+ O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为
O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) = N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
考点:考查弱电解质的电离、水的离子积常数、盐的水解、盖斯定律的应用、离子浓度比较、中和热、燃烧热的热化学方程式的书写的知识。

下列说法不正确的是
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动 NH3·H2O+H+达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
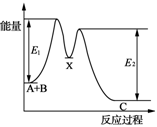
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在O2中的燃烧反应 |
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是 ( )
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1则反应 CO(g)+H2O(g)
 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=______ _____;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| | ① | H2(g)+ O2(g)= H2O(g) △H =﹣242kJ/mol; O2(g)= H2O(g) △H =﹣242kJ/mol; | ||||||||
| | ② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; | ||||||||
| | ③ | C(s)+ O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; | ||||||||
| | ④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; | ||||||||
| | ⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL | ||||||||
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | | ||
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | | ||
(1)写出能表示H2燃烧热的热化学方程式 。
(2)已知C(s)+ H2O(g)
 H2(g)+ CO(g)△H =" ___________" kJ/moL;
H2(g)+ CO(g)△H =" ___________" kJ/moL; (3)估算出C=O键能为 kJ/moL。
(4)CH4的燃烧热△H = — ___________ kJ/moL。
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为_________mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g·℃) ]。
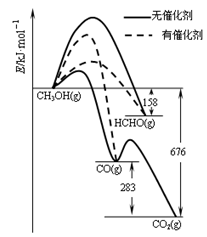
 HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0