��Ŀ����
1��400��ʱ�����ݻ�Ϊ2L���ܱ������г���1.2mol ��A��0.6mol ��B��������Ӧ���£�A��g��+B��g��?C��g��+D��g����t���Ӻ�Ӧ�ﵽƽ�⣬��ʱ���A�����ʵ���Ϊ0.8mol������˵����ȷ���ǣ�������| A�� | ��Ӧ��tmin�ڵ�ƽ������Ϊv��D��=0.4/tmol•L-1•min-1 | |
| B�� | �¶�����500��ʱ��������Ӧƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ | |
| C�� | ���������������䣬��ƽ����ϵ����ͨ��0.2molB����ԭƽ����ȣ��ﵽ��ƽ��ʱAת��������B������������� | |
| D�� | ����Ӧ��ʼʱ���ܱ������г���2.4mol ��A��1.2mol ��B���ﵽƽ������ʱ��С��t |
���� 400��ʱ�����ݻ�Ϊ2L���ܱ������г���1.2mol A�����0.6mol B���壬t���Ӻ�Ӧ�ﵽƽ�⣬��ʱ���A�����ʵ���Ϊ0.8mol����
A��g��+B��g��?C��g��+D��g��
��ʼ��mol����1.2 0.6 0 0
ת����mol����0.4 0.4 0.4 0.4
ƽ�⣨mol����0.8 0.2 0.4 0.4
A������v=$\frac{��c}{��t}$����v��D����
B����Ӧǰ�������������䣬�����ʵ�������Ũ�ȼ���400��ʱƽ�ⳣ��K=$\frac{0.4��0.4}{0.8��0.2}$=1�������¶ȣ�ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ���
C�����������������䣬��ƽ����ϵ����ͨ��0.2molB����ԭƽ����ȣ�ƽ�������ƶ���ƽ��ʱAת������������������ʵ�������0.2mol����ƽ��ʱת����BΪxmol����ʾ��ƽ��ʱ��������ʵ��������ƽ�ⳣ���з��̼�����
D������Ӧ��ʼʱ���ܱ������г���2.4mol ��A��1.2mol ��B����ЧΪ��ԭƽ��Ļ�����ѹǿ����һ������Ӧ���ʼӿ죮
��� �⣺400��ʱ�����ݻ�Ϊ2L���ܱ������г���1.2mol A�����0.6mol B���壬t���Ӻ�Ӧ�ﵽƽ�⣬��ʱ���A�����ʵ���Ϊ0.8mol����
A��g��+B��g��?C��g��+D��g��
��ʼ��mol����1.2 0.6 0 0
ת����mol����0.4 0.4 0.4 0.4
ƽ�⣨mol����0.8 0.2 0.4 0.4
A����Ӧ��tmin�ڵ�ƽ������Ϊv��D��=$\frac{\frac{0.4mol}{2L}}{tmin}$=$\frac{0.2}{t}$mol•L-1•min-1����A����
B����Ӧǰ�������������䣬�����ʵ�������Ũ�ȼ���400��ʱƽ�ⳣ��K=$\frac{0.4��0.4}{0.8��0.2}$=1�������¶ȣ�ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����B����
C�����������������䣬��ƽ����ϵ����ͨ��0.2molB����ԭƽ����ȣ�ƽ�������ƶ���ƽ��ʱAת������������������ʵ�������0.2mol����ƽ��ʱת����BΪxmol����
A��g��+B��g��?C��g��+D��g��
��ʼ��mol����1.2 0.8 0 0
ת����mol����x x x x
ƽ�⣨mol����1.2-x 0.8-x x x
��$\frac{x��x}{��1.2-x������0.8-x��}$=1�����x=0.48��ƽ��ʱB���������Ϊ$\frac{0.32mol}{2mol}$=16%��ԭƽ��ʱV���������Ϊ$\frac{0.2mol}{1.8mol}$=11.1%������ƽ��ʱB�������������C��ȷ��
D������Ӧ��ʼʱ���ܱ������г���2.4mol ��A��1.2mol ��B����ЧΪ��ԭƽ��Ļ�����ѹǿ����һ������Ӧ���ʼӿ죬�ﵽƽ������ʱ��С��tmin����D��ȷ��
��ѡ��CD��
���� ���⿼�黯ѧƽ����㡢��Ӧ���ʼ�����Ӱ�����ء�ƽ�ⳣ���ȣ�ע����������ƽ�ⳣ����Ӧ�ã�

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д��ϳɰ��õ������ж�����ȡ�ķ�����
�ٻ��ý��������ƣ�ֱ�Ӹ�ˮ��Ӧ��
�ڽ�������п����ϡ�����ϡ���ᷴӦ��
�۵��ˮ������
���ɽ�̿��ˮ��Ӧ��ȡ������C+H2O��g��$\frac{\underline{\;����\;}}{\;}$CO+H2��
������Ȼ����ȡ������CH4+H2O��g��$\frac{\underline{\;\;\;����\;\;\;}}{����}$CO+3H2
��1�������ٲ���һ����ȡ�����ķ�����д���÷�Ӧ�Ļ�ѧ����ʽ2Al+2NaOH+2H2O=2NaAlO2+3H2����
��2����֪�йط�Ӧ�������仯��ͼ�����ݷ�Ӧ���ʱ��H=��a+3b-c��kJ•mol-1��

����3��2L���ܱ������У�����ͬ���¶��¡�ʹ����ͬ�Ĵ����ֱ���з�Ӧ��3H2��g��+N2��g��$\frac{\underline{\;���¸�ѹ\;}}{����}$2NH3��g��������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й����������
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 3mol H2��2mol N2 | 6mol H2��4mol N2 | 2mol NH3 |
| �ﵽƽ���ʱ�䣨min�� | 5 | 8 | |
| ƽ��ʱN2��Ũ�ȣ�mol•L-1�� | c1 | 1.5 | |
| NH3��������� | ��1 | ��3 | |
| ��������ܶȣ�g•L-1�� | ��1 | ��2 |
a��2c1��1.5mol/L b��2��1=��2 c����3=��1
��4���ڸ��¶��¸÷�Ӧ��ƽ�ⳣ��K=$\frac{��2-2{c}_{1}��^{2}}{{c}_{1}����3{c}_{1}-1.5��^{3}}$���ú�c1�Ĵ���ʽ��ʾ����
��5���������з�Ӧ�ӿ�ʼ����ƽ��ķ�Ӧ����Ϊv��H2��=0.3mol/��L��min����
���ð�����ȡ����[CO��NH2��2]�ķ�ӦΪ��2NH3��g��+CO2��g��?CO ��NH2��2��l��+H2O��g����ij�¶��£�Ϊ��һ�����CO2��ƽ��ת���ʣ����д�ʩ���ܴﵽĿ����ab��
a�����NH3��Ũ�� b������ѹǿ c����ʱת�����ɵ����� d��ʹ�ø���Ч�Ĵ�����
| A�� | 2.5 mol | B�� | 4.5 mol | C�� | 5mol | D�� | 7.5 mol |
��������

| A�� | �ó����ʯ��ˮ�ɼ���NaHCO3��Na2CO3 | |
| B�� | ��Ԫ���ڵڢۡ����б��������ڵڢ��б���ԭ | |
| C�� | ��ҵ��һ���ý���������ˮMgCl2��Ӧ��ȡMg���� | |
| D�� | ��ˮ�л����е�Ԫ�أ�ֻ�轫��ˮ�еĵ������Ϳ��Եõ��ⵥ�� |
 Si��SiC��4CO��
Si��SiC��4CO��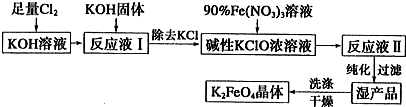
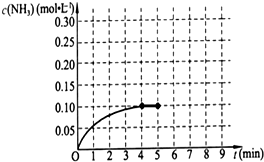 ��֪��ҵ�Ϻϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0����һ���Ϊ2L���ܱ��ݻ��У�����0.20mol��N2��0.60mol��H2����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ��
��֪��ҵ�Ϻϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0����һ���Ϊ2L���ܱ��ݻ��У�����0.20mol��N2��0.60mol��H2����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ�� �������������С��������淽����С�����ƽ��״̬������
�������������С��������淽����С�����ƽ��״̬������
