题目内容
4.质量相同的H2、NH3、SO2、O2四种气体,所含分子数目最少的是SO2,相同温度和相同压强下,体积最大的是H2.分析 根据N=nNA=$\frac{m}{M}{N}_{A}$计算分子数;同温同压下,气体摩尔体积相等,根据V=nVm=$\frac{m}{M}{V}_{m}$计算气体体积.
解答 解:H2、NH3、SO2、O2四种气体的摩尔质量分别是2g/mol、17g/mol、64g/mol、32g/mol,根据N=nNA=$\frac{m}{M}{N}_{A}$知,相同质量时,气体分子数与摩尔质量成反比,所含分子数最少说明该气体摩尔质量最大,为SO2;
同温同压下,气体摩尔体积相等,根据V=nVm=$\frac{m}{M}{V}_{m}$知,气体体积与摩尔质量成反比,体积最大说明该气体摩尔质量最小,为H2,故答案为:SO2;H2.
点评 本题考查物质的量有关计算,侧重考查学生分析判断能力,明确各个物理量关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
15.某同学的实验报告中有如下数据,其中数据合理的是( )
| A. | 用托盘天平称取3.25gNaCl | |
| B. | 用量筒量取10.51mL盐酸 | |
| C. | 用酸式滴定管量取20.00mLKMnO4溶液 | |
| D. | 用容量瓶配制216mL0.1mol/L的NaOH溶液 |
19.0.25mol Ca(OH)2跟0.3mol H3PO4在一定条件下充分反应,得到CaHPO4和Ca(H2PO4)2,则这两种产物的物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 4:1 |
9.下列叙述不正确的是( )
| A. | 符合通式:CnH2n-2的有机物一定是炔烃 | |
| B. | 乙炔分子中碳碳叁键的键能不是碳碳单键和碳碳双键的键能之和 | |
| C. | 等质量的烃中含氢量越高,充分燃烧时,消耗的氧气越多 | |
| D. | 1-丁炔分子中的四个碳原子在同一条直线上 |
14.下列说法不正确的是( )
| A. | pH相同的①CH3COONa②NaHCO3两种溶液的c(Na+):②>① | |
| B. | 反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0 | |
| C. | 向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液呈碱性 | |
| D. | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,这一事实可以用勒夏特列原理解释 |
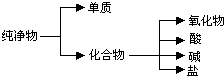 (1)纯净物根据其组成和性质可进行如下分类:
(1)纯净物根据其组成和性质可进行如下分类: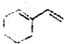 与溴的四氯化碳溶液反应(1:1)的产物的结构简式.
与溴的四氯化碳溶液反应(1:1)的产物的结构简式.