题目内容
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: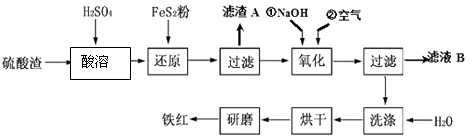
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;“滤渣A”主要成份的化学式为 .
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请完成该反应的离子方程式:FeS2+14Fe3++H2O═15Fe2++SO ![]() + .
+ .
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) .
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
【答案】
(1)Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;SiO2
(2)8;2;16H+
(3)4Fe2++O2+2H2O+8OH﹣=4Fe(OH)3↓(或Fe2++2OH﹣=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3)
(4)3.2~3.8(或之间的数据值);Na2SO4、Al2(SO4)3、MgSO4
【解析】解:(1)氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;硫酸渣中只有二氧化硅不与稀硫酸反应,所以“滤渣A”主要成份的化学式为SiO2 , 所以答案是:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;SiO2; (2)FeS2 中的S元素的化合价是﹣1价,生成物中Fe的化合价是+2价,S的化合价是+6价,整体升高14价,而Fe3+的化合价降低1价,根据升降化合价总数相等,所以Fe3+的系数是14,则SO42﹣的系数是2,再根据元素守恒和电荷守恒判断生成物中还有氢离子,其系数为16,则水的系数是8,配平后的反应为:FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+ , 所以答案是:8;2;16H+;(3)Fe2+与OH﹣反应生成4Fe(OH)2 , Fe(OH)2不稳定易被氧气氧化为Fe(OH)3 , 用化合价升价法配平方程式为:4Fe2++O2+2H2O+8OH﹣=4Fe(OH)3↓;(或Fe2++2OH﹣=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3),
所以答案是:4Fe2++O2+2H2O+8OH﹣=4Fe(OH)3↓(或Fe2++2OH﹣=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3);(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间;
未沉淀的离子为:Na+、Mg2+、Al3+ , 故滤液B可以回收的物质有:Na2SO4、Al2(SO4)3、MgSO4 ,
所以答案是:3.2~3.8(或之间的数据值);Na2SO4、Al2(SO4)3、MgSO4 .