题目内容
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示:
(1)SO2气体还原Fe3+生成的还原产物是(填离子符号),参加反应的SO2 和Fe3+的物质的量之比是 .
(2)下列实验方案适用于在实验室制取所需SO2的是(双选,填序号).
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与热浓H2SO4
(3)装置C的作用是 .
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(双选,填序号).A蒸发皿 B 石棉网 C 漏斗 D 烧杯 E 玻璃棒 F 坩埚
(5)在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第三份试液加入用稀盐酸酸化的BaCl2 , 产生白色沉淀.
上述方案不合理的一个是 , 原因是 .
(6)上述装置中能表明I﹣的还原性弱于SO2的现象是 .
【答案】
(1)Fe2+;1:2
(2)BD
(3)吸收SO2尾气,防止污染空气
(4)BF
(5)方案①;因为A的溶液中含有SO2 , SO2也能使KMnO4溶液褪色
(6)B中蓝色溶液褪色
【解析】解:(1)2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ , SO2气体还原Fe3+生成的还原产物是Fe2+ , 参加反应的SO2和Fe3+的物质的量之比等于计量数之比为1:2,所以答案是:Fe2+;1:2;(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错误;
B、浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,和亚硫酸钠发生复分解反应生成二氧化硫气体,故B正确;
C、固体硫在纯氧中燃烧,操作不容易控制,故C错误;
D、Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,可以制备得到二氧化硫气体,故D正确,
CuSO4+SO2↑+2H2O,可以制备得到二氧化硫气体,故D正确,
故选BD,
所以答案是:BD;(3)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以装置C的作用是吸收SO2尾气,防止污染空气,
所以答案是:吸收SO2尾气,防止污染空气;(4)操作步骤:蒸发需用到A 蒸发皿,E.玻璃棒,冷却结晶需用到烧杯,过滤需用到C.漏斗,D.烧杯,E.玻璃棒,故不需要B.石棉网、F.坩埚,
所以答案是:BF;(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以不合理的是方案①,因为A的溶液中含有SO2 , SO2也能使KMnO4溶液褪色,
所以答案是:方案①,因为A的溶液中含有SO2 , SO2也能使KMnO4溶液褪色;(6)I2+SO2+2H2O=2HI+H2SO4二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,所以答案是:B中蓝色溶液褪色.

【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: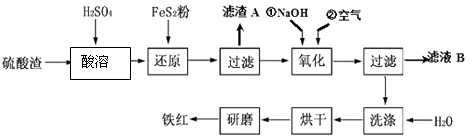
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;“滤渣A”主要成份的化学式为 .
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请完成该反应的离子方程式:FeS2+14Fe3++H2O═15Fe2++SO ![]() + .
+ .
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) .
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |