题目内容
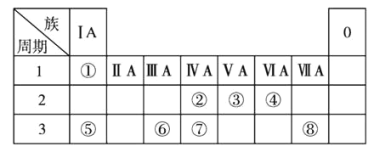
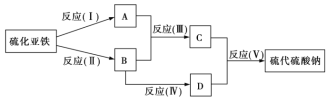
【题目】下图表示由元素周期表中1到20号且不同主族的元素组成的单质及化合物之间的转化关系(产物中的水已略去)。其中A为黄绿色气体单质,D有漂白性;在实验室中常用固体B和固体C加热制取刺激性气味F;F和G的组成元素相同,G与H分子所含电子数相同。
请回答
(1)单质A的组成元素在周期表中的位置是________;
(2)B的化学式为________,F的电子式为________,C中所含化学键类型有_______;
(3)写出反应②的化学方程式_____________;
(4)反应④中F和气体H在空气中相遇时的实验现象为__________写出的F一种具体用途_______________;
(5)向具有漂白作用的D溶液中加入H的浓溶液有A生成,其反应的离子方程式为______________。
(6)砷元素(As)与上述某元素处于同一主族。砷酸铅可用作杀虫剂。已知:
①在砷酸铅中,砷处于最高价态,铅处于稳定价态。
②砷酸铅是正砷酸对应的盐,1mol正砷酸分子中含有8mol原子.
砷的最高价氧化物的化学式为___________砷酸铅的化学式为________
【答案】第三周期VIIA Ca(OH) 2 ![]() 离子键 共价键 2NH4Cl+Ca(OH)2
离子键 共价键 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 有白烟产生 制氮肥(或制硝酸、制纯碱、制铵盐或做制冷剂) ClO- +Cl- +2H + =Cl2↑+H2O As2O5 Pb3(AsO4)2
CaCl2+2NH3↑+2H2O 有白烟产生 制氮肥(或制硝酸、制纯碱、制铵盐或做制冷剂) ClO- +Cl- +2H + =Cl2↑+H2O As2O5 Pb3(AsO4)2
【解析】
A为黄绿色气体单质,A为Cl2,D有漂白性,则D为次氯酸或其盐类;在实验室中,常用固体B和固体C加热制取刺激性气味气体F,根据框图,B为碱,应为Ca(OH)2,则C为NH4Cl,二者反应生成氨气,则F为NH3,E为CaCl2,则D为Ca(ClO)2;根据F可与H生成C,则H为HCl,根据F与G的组成元素相同,G与H分子所含电子数相同,其中HCl含有18个电子,则G为N2H4,结合元素及其化合物的性质分析解答。
(1)A为氯气,Cl的原子序数为17,位于元素周期表中第三周期ⅤⅡA族,故答案为:第三周期ⅤⅡA族;
(2)根据上述分析可知,B为Ca(OH)2,F为NH3,电子式为![]() ;C为NH4Cl,属于离子化合物,其电子式为
;C为NH4Cl,属于离子化合物,其电子式为![]() ,含有离子键和共价键,故答案为:Ca(OH)2;
,含有离子键和共价键,故答案为:Ca(OH)2;![]() ;离子键、共价键;
;离子键、共价键;
(3)反应②是氢氧化钙和氯化铵固体加热制取氨气,反应的化学方程式:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)反应④的方程式为NH3+HCl═NH4Cl,反应生成氯化铵固体,有白烟生成,NH4Cl常用作氮肥、制硝酸、制纯碱、制铵盐、做制冷剂,故答案为:有白烟产生;制氮肥(或制硝酸、制纯碱、制铵盐、做制冷剂);
(5)HClO为弱电解质,在Ca(ClO)2溶液中加入盐酸有HClO生成,ClO-在酸性条件下具有强氧化性,与Cl-反应生成Cl2,发生反应为ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(6)砷的最高价为+5价,氧化物中氧元素是-2价,砷的最高价氧化物的化学式为As2O5;
1mol正砷酸分子中含有8mol原子,砷酸的分子式为H3AsO4;铅处于稳定价态,则砷酸铅中铅元素是+2价,砷酸根为-3价,砷酸铅的化学式为Pb3(AsO4)2,故答案为:As2O5;Pb3(AsO4)2。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度t的关系:
CO(g)+H2O(g),其平衡常数K和温度t的关系:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:_________;
(2)该反应的正反应为_________反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________。
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2)=c(CO)=c(H2)=c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是_________(填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率_________(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其可能原因是__________________________________________。
Ⅱ.设在容积可变的密闭容器中充入10molN2(g)和10molH2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。
(6)求该条件下反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
【题目】某无色混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Al3+、NH4+、Na+ |
可能大量含有的阴离子 | Cl-、AlO2-、SO42-、MnO4-、Br-、I-、CO32- |
为探究其成分,进行了以下探究实验。
探究一:
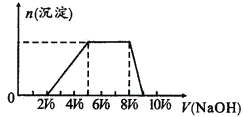
甲同学取一定量的混合溶液,用pH试纸检验,溶液pH<7;向其中逐液加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
探究二
乙同学取一定量的混合溶液,向溶液中加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
探究三:
另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
(1)该溶液中一定含有的阴离子是___;其中能确定离子浓度之比的,对应离子物质的量浓度之比为___;不能肯定是否含有的离子是___。确定其中阳离子的实验方法为___。
(2)请写出沉淀减少过程中发生反应的离子方程式___。
【题目】下列实验中“实验内容”与对应“实验现象和结论”的关系都正确的是( )
选项 | 实验内容 | 实验现象和结论 |
A | 向FeCl3+3KSCN | 溶液的血红色变浅,说明增加生成物浓度,平衡逆移 |
B | 分别往甲:4mL0.1mol·L-1、乙:4mL0.2mol·L-1的酸性KMnO4溶液中加入2mL0.1mol·L-1H2C2O4溶液,记录褪色时间 | 乙先褪色,说明反应物浓度越大,反应速率越快,越先褪色 |
C | 室温下,5mL0.1mol·L-1Na2S2O3溶液中加入5mL0.1mol·L-1稀H2SO4溶液,观察现象 | 溶液立即出现浑浊,说明不可逆反应是瞬间完成的 |
D | 向饱和硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液 | 无明显现象酸性:H3BO3<H2CO3 |
A.AB.BC.CD.D