题目内容
某研究性学习小组利用下列原料和流程制备CuSO4.SH2O.
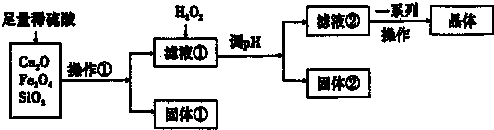
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+.
(1)操作①的名称为 .
(2)若固体①的成分为混合物,则其成分的化学式为 .
(3)将H2O2加入滤液①中,发生反应的离子方程式为 .
(4)调pH可选用的药品为 .
A.NaOH溶液B.CuO C.氨水 D.CuCO3
(5)获得的CuSO4?5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是 .

已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+.
(1)操作①的名称为
(2)若固体①的成分为混合物,则其成分的化学式为
(3)将H2O2加入滤液①中,发生反应的离子方程式为
(4)调pH可选用的药品为
A.NaOH溶液B.CuO C.氨水 D.CuCO3
(5)获得的CuSO4?5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是
分析:(1)根据流程来选择操作名称;
(2)根据硫酸和原料的反应原理来确定固体的化学成分;
(3)过氧化氢具有氧化性,会氧化还原性的物质,滤液中含Cu2+、Fe2+、Fe3+,Fe2+可被过氧化氢氧化为Fe3+;
(4)调节pH从不能引入新的杂质的角度来选择试剂;
(5)从溶解性角度考虑.
(2)根据硫酸和原料的反应原理来确定固体的化学成分;
(3)过氧化氢具有氧化性,会氧化还原性的物质,滤液中含Cu2+、Fe2+、Fe3+,Fe2+可被过氧化氢氧化为Fe3+;
(4)调节pH从不能引入新的杂质的角度来选择试剂;
(5)从溶解性角度考虑.
解答:解:(1)通过操作①得到固体和溶液,故此操作为过滤,故答案为:过滤;
(2)因Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+,所以硫酸与氧化亚铜反应方程式为:H2SO4+Cu2O=CuSO4+Cu+H2O,
四氧化三铁可溶于硫酸,反应方程式为:Fe3O4+4H2SO4=Fe2(SO4)3+FeSO4+4H20,二氧化硅与硫酸不反应,故过滤后得到的固体为:SiO2、Cu,
故答案为:SiO2、Cu;
(3)滤液中含Cu2+、Fe2+、Fe3+,Fe2+可被过氧化氢氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)调节pH从不能引入新的杂质的角度来选择试剂,A项会引入钠离子,C项会引入铵根离子,故答案为:B、D;
(5)CuSO4?5H2O在酒精中的溶解度小,用酒精洗涤可降低CuSO4?5H2O的溶解度,减少CuSO4?5H2O的损失,故答案为:减少CuSO4?5H2O晶体的损失.
(2)因Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+,所以硫酸与氧化亚铜反应方程式为:H2SO4+Cu2O=CuSO4+Cu+H2O,
四氧化三铁可溶于硫酸,反应方程式为:Fe3O4+4H2SO4=Fe2(SO4)3+FeSO4+4H20,二氧化硅与硫酸不反应,故过滤后得到的固体为:SiO2、Cu,
故答案为:SiO2、Cu;
(3)滤液中含Cu2+、Fe2+、Fe3+,Fe2+可被过氧化氢氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)调节pH从不能引入新的杂质的角度来选择试剂,A项会引入钠离子,C项会引入铵根离子,故答案为:B、D;
(5)CuSO4?5H2O在酒精中的溶解度小,用酒精洗涤可降低CuSO4?5H2O的溶解度,减少CuSO4?5H2O的损失,故答案为:减少CuSO4?5H2O晶体的损失.
点评:本题考查了铜及其化合物的知识,主要利用题给信息,结合流程图和实验目的正确解答.

练习册系列答案
相关题目
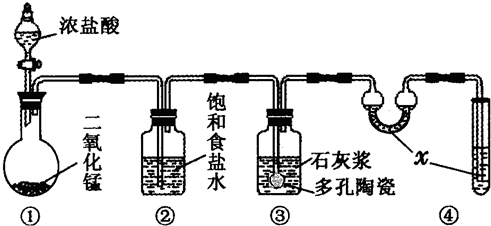


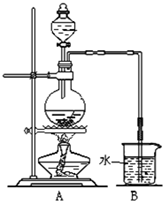 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.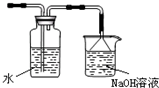 )
)