题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g)==2NO2(g) △H= +133 kJ/mol
H2O(g)==H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式__________________。
Ⅱ.脱碳:向2L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应CO2(g)+3H2(g) ![]() CH3OH(l) + H2O(l)。
CH3OH(l) + H2O(l)。
(1)①该反应自发进行的条件是_________________(填“低温”“高温”或“任意温度”)。②下列叙述能说明此反应达到平衡状态的是________________________。
a.混合气体的平均式量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H-H键断裂
(2)改变温度,使反应CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K( I ) ______K(II)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应I,前10 min内的平均反应速率v(CH3OH) =________,在其他条件不变下,若30 min时只改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1_____T2(填填“>”“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。
【答案】4H2(g) +2NO2 (g) =N2 (g) +4H2O(g) △H=-1100.2kJ/mol 低溫 de < < 0.025mol/L·min < 不
【解析】
Ⅰ、依据热化学方程式和盖斯定律计算所得热化学方程式;
Ⅱ、(1)①自发进行的判断依据是△H-T△S<0,结合反应特征分析判断需要的条件;
②平衡标志是正逆反应速率相同,个组分含量保持不变,原则是变量不变分析选项;
(2)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
②反应速率V=![]() 计算得到氢气反应速率,速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量。
计算得到氢气反应速率,速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量。
Ⅰ.H2的热值为142.9kJg-1 ,则燃烧热为285.8kJ/mol,因此①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJ/mol,②N2(g)+2O2(g)=2NO2(g)△H=+133 kJ/mol,③H2O(g)=H2O(l)△H=-44 kJ/mol,根据盖斯定律,将①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2 kJ/mol,故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2 kJ/mol;
O2(g)=H2O(l)△H=-285.8kJ/mol,②N2(g)+2O2(g)=2NO2(g)△H=+133 kJ/mol,③H2O(g)=H2O(l)△H=-44 kJ/mol,根据盖斯定律,将①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2 kJ/mol,故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2 kJ/mol;
Ⅱ.(1)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△H-T△S<0,故答案为:低温;
②CO2(g)+3H2(g)═CH3OH(l)+H2O(l)。a、混合气体的平均式量始终保持不变,不能说明反应达到平衡状态,故a错误; b、向2L密闭容器中加入2mol CO2、6mol H2,按照1∶3反应,所以过程中CO2和H2的体积分数始终保持不变,故b错误;c、向2L密闭容器中加入2mol CO2、6mol H2,按照1∶3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故c错误;d、反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故d正确;e、1mol CO2生成的同时有3mol H-H键断裂,说明正逆反应速率相同,反应达到平衡状态,故e正确;故答案为:de;
(2)①CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大,故答案为:<;<;
CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大,故答案为:<;<;
② CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol) 2 6 0 0
变化量(mol) 1 3 1 1
30min量(mol) 1 3 1 1
对反应I,前10min内的平均反应速率v(CH3OH)=![]() v(H2)=
v(H2)=![]() ×
× =0.025molL-1min-1;若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,氢气增加,说明平衡逆向进行,温度升高T2>T1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),对正逆反应的影响程度相同,平衡不变,故答案为:0.025molL-1min-1 ;<;不。
=0.025molL-1min-1;若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,氢气增加,说明平衡逆向进行,温度升高T2>T1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),对正逆反应的影响程度相同,平衡不变,故答案为:0.025molL-1min-1 ;<;不。

 智慧小复习系列答案
智慧小复习系列答案【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
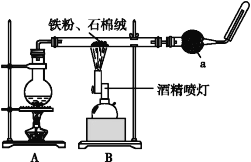
(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
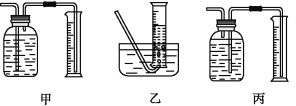
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |