题目内容
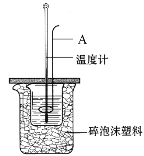
【题目】某实验需 1mol·Lˉ1 NaOH 溶液 90mL,配制该 NaOH 溶液的几个关键实验步骤和操作示意图如下:
① ②
②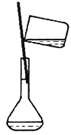 ③
③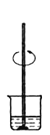 ④
④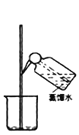 ⑤
⑤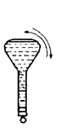 ⑥
⑥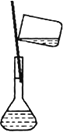
下列说法正确的是
A.用托盘天平称取 3.6g 氢氧化钠固体
B.容量瓶使用前先检漏,再用蒸馏水洗涤,干燥后才可用
C.操作①时,若俯视容量瓶的刻度线,使配得的NaOH溶液浓度偏低
D.上述操作的先后顺序是③②④⑥①⑤
【答案】D
【解析】
A.需要 1molL-1NaOH 溶液 90mL,应选择100mL容量瓶,需要氢氧化钠的质量:0.1L×1mol/L×40g/mol=4.0g,故A错误;
B.容量瓶带有瓶塞,为防止使用过程中漏水,使用前应查漏,然后洗涤,不需要干燥,故B错误;
C.俯视容量瓶的刻度线导致溶液体积偏小,依据cc=![]() 可知溶液浓度偏高,故C错误;
可知溶液浓度偏高,故C错误;
D.配制一定物质的量浓度的溶液的步骤为:计算.称量.溶解.冷却.移液.洗涤.定容.摇匀等,正确的操作顺序为:③②④⑥①⑤,故D正确;
故选:D。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g)==2NO2(g) △H= +133 kJ/mol
H2O(g)==H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式__________________。
Ⅱ.脱碳:向2L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应CO2(g)+3H2(g) ![]() CH3OH(l) + H2O(l)。
CH3OH(l) + H2O(l)。
(1)①该反应自发进行的条件是_________________(填“低温”“高温”或“任意温度”)。②下列叙述能说明此反应达到平衡状态的是________________________。
a.混合气体的平均式量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H-H键断裂
(2)改变温度,使反应CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K( I ) ______K(II)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应I,前10 min内的平均反应速率v(CH3OH) =________,在其他条件不变下,若30 min时只改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1_____T2(填填“>”“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。