��Ŀ����
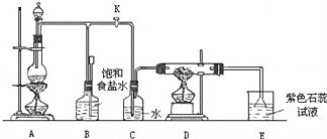
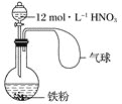
����Ŀ����ͼ������ˮ������Ӧ��ʵ��װ�á���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ����(ʯ���������²��ϣ���ˮ��������Ӧ)�Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ���������ˮ������Ӧ��ʵ�顣
��1����ʵ�鷴Ӧ�ķ�Ӧ����ʽΪ��___��
��2������a��������___��
��3��ijͬѧΪ���о�һ��ʱ�������۵�ת���ʣ����������ʵ�飺ȷ����һ�����������۽��з�Ӧ��������Ӧ�����������������������۵�ת���ʡ�
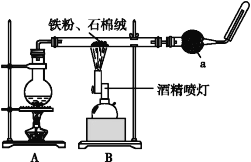
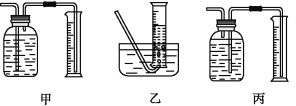
�ٸ�ͬѧӦ���ȵ�ȼ__(�A����B��)���ľƾ���(��ƾ����)�������������������ѡ����ͼ��___(��ס����ҡ�����)װ�á�
�ڳ�ȡ5.6g����������ʯ����ϣ�Ȼ����ȷ�Ӧһ��ʱ�䡣���������������ڱ�״����Ϊ0.896L�������۵�ת����Ϊ__����ת����=![]() ��
��
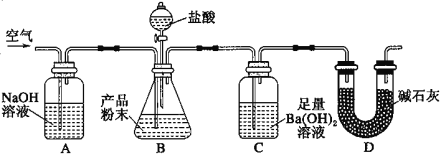
��4����Ӳ�ʲ������з�Ӧ��Ĺ�������ȫ��ȡ�������ձ��У����������������ܽⲢ���ˣ�Ϊ̽����Ӧ����Һ�п��ܵ������ӣ�С��ͬѧ��������ʵ�飬���㽫�±�����������
���� | ���� | ����(�����ӷ���ʽ��ʾ) | ���� |
��.ȡ�����μ�KSCN��Һ | ��Һ�����ɫ��Fe3+��KSCN��Һ��Ӧ�Ժ�ɫ�� | ��Fe3O4+8H+=Fe2++2Fe3++4H2O ��____ | ��.��Ӧ�����Һ��������Ϊ___ |
��.ȡ�����μ�NaOH��Һ | �տ�ʼ����������һ��ʱ����ȳ��ְ�ɫ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ | ��___ ��Fe2++2OH��=Fe(OH)2������ɫ�� 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
���𰸡�3Fe+4H2O��g��![]() Fe3O4+4H2 ����� A �� 30% Fe+2Fe3+=3Fe2+ OH��+H+=H2O H����Fe2��
Fe3O4+4H2 ����� A �� 30% Fe+2Fe3+=3Fe2+ OH��+H+=H2O H����Fe2��
��������
��A�ṩˮ��������B�з�Ӧ����ʵ�鷴Ӧ�ķ�Ӧ����ʽΪ3Fe+4H2O��g��![]() Fe3O4+4H2��
Fe3O4+4H2��
������a�������Ǹ���ܡ�
�����Ƚ�A���ƾ��Ƶ�ȼ����ˮ������������װ�ã��ٵ�ȼB���ƾ��ƣ�����ˮ���ⶨ���������
����ȡ5.6g���ۼ��������ʵ���Ϊ0.1mol�����������������ڱ�״����Ϊ0.896L�����ʵ���Ϊ0.04mol������3Fe+4H2O��g��![]() Fe3O4+4H2�����������ʵ���Ϊ0.03mol���ټ������۵�ת����Ϊ��
Fe3O4+4H2�����������ʵ���Ϊ0.03mol���ټ������۵�ת����Ϊ��
����Һ�����ɫ��Fe3+��KSCN��Һ��Ӧ�Ժ�ɫ����˵����Һ�е�������������Ӧ�������������ӣ�Fe+2Fe3+=3Fe2+�������������ƣ��տ�ʼ����������˵��������кͷ�Ӧ�����ӷ�ӦΪOH��+H+ = H2O���Ӷ�˵����Ӧ�����Һ�������ӡ�
��A�ṩˮ��������B�з�Ӧ����ʵ�鷴Ӧ�ķ�Ӧ����ʽΪ3Fe+4H2O��g��![]() Fe3O4+4H2���ʴ�Ϊ��3Fe+4H2O��g��
Fe3O4+4H2���ʴ�Ϊ��3Fe+4H2O��g��![]() Fe3O4+4H2��
Fe3O4+4H2��
������a�������Ǹ���ܣ��ʴ�Ϊ������ܡ�
�����Ƚ�A���ƾ��Ƶ�ȼ����ˮ������������װ�ã��ٵ�ȼB���ƾ��ƣ�����ˮ���ⶨ�����������˲�����ѡ����ͼ�м�װ�ã��ʴ�Ϊ��A���ס�
����ȡ5.6g���ۼ��������ʵ���Ϊ0.1mol�����������������ڱ�״����Ϊ0.896L�����ʵ���Ϊ0.04mol������3Fe+4H2O��g��![]() Fe3O4+4H2�����������ʵ���Ϊ0.03mol�������۵�ת����Ϊ
Fe3O4+4H2�����������ʵ���Ϊ0.03mol�������۵�ת����Ϊ![]() ���ʴ�Ϊ��30%��
���ʴ�Ϊ��30%��
����Һ�����ɫ��Fe3+��KSCN��Һ��Ӧ�Ժ�ɫ����˵����Һ�е�������������Ӧ�������������ӣ�Fe+2Fe3+=3Fe2+�������������ƣ��տ�ʼ����������˵��������кͷ�Ӧ�����ӷ�ӦΪOH��+H+ = H2O���Ӷ�˵����Ӧ�����Һ��������ΪH����Fe2�����ʴ�Ϊ��Fe+2Fe3+=3Fe2+��OH��+H+ = H2O��H����Fe2����

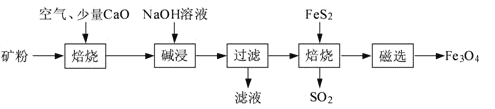
 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�����Ŀ����ҵȼ��ú��ʯ�͵Ȼ�ʯȼ���ͷų�������������(NOx)��CO2��SO2�����壬������Ⱦ�������Է���������������̼����������ʵ����ɫ�������������á�
I.��������֪��H2����ֵΪ142.9 kJ/g(��ֵ�DZ�ʾ��λ����ȼ����ȫȼ��ʱ���ų�������)��
N2(g) + 2O2(g)==2NO2(g) ��H= +133 kJ/mol
H2O(g)==H2O(l) ��H=- 44 kJ/mol
���������£�H2��ԭNO2����ˮ���������������ʵ��Ȼ�ѧ����ʽ__________________��
��.��̼����2L�ܱ������м���2 mol CO2��6 mol H2�����ʵ��Ĵ��������£�������ӦCO2(g)+3H2(g) ![]() CH3OH(l) + H2O(l)��
CH3OH(l) + H2O(l)��
(1)�ٸ÷�Ӧ�Է����е�������_________________(���������������������������¶�������������������˵���˷�Ӧ�ﵽƽ��״̬����________________________��
a.��������ƽ��ʽ�����ֲ���
b.CO2��H2������������ֲ���
c.CO2��H2��ת�������
d.���������ܶȱ��ֲ���
e.1 mol CO2���ɵ�ͬʱ��3 mol H-H������
(2)�ı��¶ȣ�ʹ��ӦCO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g) ��H<0�е��������ʶ�Ϊ��̬����ʼ�¶������ͬ(T1�桢2L.�ܱ�����)����Ӧ�����в������ݼ��±���
CH3OH(g) + H2O(g) ��H<0�е��������ʶ�Ϊ��̬����ʼ�¶������ͬ(T1�桢2L.�ܱ�����)����Ӧ�����в������ݼ��±���
��Ӧʱ�� | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
��ӦI ���º��� | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
��ӦII���Ⱥ��� | 0 min | 0 | 0 | 2 | 2 |
�ٴﵽƽ��ʱ����ӦI��II�Աȣ�ƽ�ⳣ��K( I ) ______K(II)(����>����<������=������ͬ����ƽ��ʱCH3OH��Ũ��c(I)_______c(II)��
�ڶԷ�ӦI��ǰ10 min�ڵ�ƽ����Ӧ����v(CH3OH) =________�����������������£���30 minʱֻ�ı��¶�ΪT2�棬��ʱH2�����ʵ���Ϊ3.2 mol����T1_____T2(������>����<������=��)����30 minʱֻ���������ٳ���1 mol CO2(g)��1mol H2O(g)����ƽ��______�ƶ�(����������������������������)��