题目内容
9.用质量分数为36.5%的盐酸(密度为1.16g•cm-3)配制1mol•L-1的稀盐酸.现实验室仅需要这种盐酸270mL,试回答下列问题:(1)配制稀盐酸时,应选用容量为500mL的容量瓶.
(2)经计算需要21.6mL浓盐酸,在量取时宜选用下列量筒中的C.
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中.
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.w
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)③①④②.
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是偏低(填“偏高”、“偏低”或“无影响”).若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是偏低(填“偏高”、“偏低”或“无影响”).
分析 (1)根据配制溶液的体积,常用容量瓶的规格选取对应的容量瓶;
(2)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,依据溶液稀释前后溶质的物质的量不变计算需要浓盐酸的体积,依据浓盐酸的体积选择合适的量筒;
(3)依据配制一定物质的量浓度的一般步骤排序;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)要配制盐酸270mL,则需要选择500ml的容量瓶,
故答案为:500;
(2)质量分数为36.5%的盐酸(密度为1.16g•cm-3)的物质的量浓度为:$\frac{1000×1.16×36.5%}{36.5}$=11.6mol/L,设需要浓盐酸的体积为V,依据溶液稀释前后溶质的物质的量不变得:V×11.6mol/L=500mL×1mol/L,解得V=21.6mL,应选择25mL的容量瓶;
故选:21.6;C;
(3)配制一定物质的量浓度的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:③①④②;
故答案为:③①④②;
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,导致量取的氯化氢的物质的量偏小,溶液的浓度偏低;
若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,导致溶质的物质的量偏小,溶液的浓度偏低;
故答案为:偏低;偏低.
点评 本题考查了配置一定物质的量浓度溶液,明确实验的计算方法以及仪器的选用原则是解题关键,题目难度不大.

练习册系列答案
相关题目
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1L 0.1 mol/L NaHCO3溶液中含有HCO3-数目为0.1NA | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 1 mol Fe与足量稀HNO3反应,转移电子数目为2NA |
1.化学与生产、生活、环境关系密切,下列说法正确的是( )
| A. | 提倡使用太阳能、风能、天然气、地热能等新能源,以保护环境 | |
| B. | “玉兔号”的太阳能电池板主要由二氧化硅制成 | |
| C. | 为除去锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加盐酸溶解 | |
| D. | 碱性洗涤剂的去污能力比中性洗涤剂弱,是由于油脂在中性溶液中更易水解 |
4.在恒容密闭容器中A(g)+3B(g)?2C(g)△H<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是( )
| A. | 容器中混合气体的平均相对分子质量增大 | |
| B. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 正反应速率和逆反应速率都变小,C的百分含量增加 | |
| D. | 混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
13.镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为( )
| A. | 26 | B. | 29.1g | C. | 29.5g | D. | 24g |
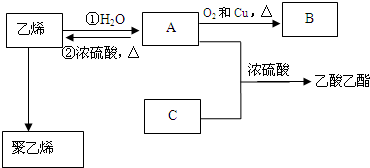
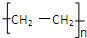 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基.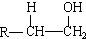 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑. 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题: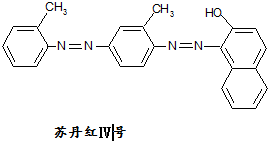 据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.
据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.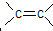 空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.
空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.