题目内容
5.化合物甲和NaAlH4都是重要的还原剂.一定条件下金属钠和H2反应生成甲.甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4.将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况) 的H2.请推测并回答:(1)甲的化学式NaH;
(2)甲与AlCl3反应得到NaAlH4的化学方程式:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水发生氧化还原反应的化学方程式:NaAlH4+2H2O=NaAlO2+4H2↑;
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3) 脱锈过程发生的化学方程式3NaH+Fe2O3=2Fe+3NaOH;
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到的固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的.判断该同学设想的制备和验纯方法的合理性并说明理由制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
分析 (1)钠元素在化合物中只能形成+1价,据此结合生成氢气的物质的量判断其化学式即可;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,据此书写;
(3)NaAlH4与水反应生成氢气,应是水中的H元素与NaH中的H元素之间得失电子,据此书写即可;
(4)由题意可知NaH常做还原剂那么铁锈为氧化剂,反应生成铁单质,据此书写;
(5)制备过程中未指明吸收杂质气体HCl,据此解答;氢气与金属钠反应未指明钠的用量,钠可能过量,过量的钠也可以与水反应生成氢气.
解答 解:(1)Na在化合价中呈现+1价,故该物质的化学式可能为NaH,又甲与AlCl3反应可得到NaAlH4,Al的化合价为+3,故H元素的化合价为-1,4.80g甲加热至完全分解,得到金属钠和2.24L,即0.1mol氢气,
化学反应方程式为:2NaH$\frac{\underline{\;加热\;}}{\;}$2Na+H2↑
48g 22.4L
4.8g 2.24L
故此化合物为NaH,故答案为:NaH;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,根据原子守恒推测另一种生成物,化学反应方程式为:4NaH+AlCl3=NaAlH4+3NaCl,故答案为:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水反应生成氢气,即NaH中H化合价升高,水中H元素化合价降低,化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;
(4)NaH常做还原剂(H化合价升高为+1价),铁锈在此为氧化剂(Fe化合价降低为0价),反应生成铁单质,化学反应方程式为:3NaH+Fe2O3=2Fe+3NaOH,故答案为:3NaH+Fe2O3=2Fe+3NaOH;
(5)稀盐酸具有挥发性,且可以利用浓硫酸干燥,故制取的氢气中可能混有杂质气体HCl,那么制取的甲中就混有NaCl,验证过程中未排除金属钠的干扰,过量的金属能也可以与水反应生成氢气.
故答案为:制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
点评 本题主要考查的是常见元素以及其化合物的知识,综合性较强,涉及物质的判断、化学反应方程式书写、实验方案的评价等,难度较大.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 26 | B. | 29.1g | C. | 29.5g | D. | 24g |
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═AlO2-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na:2 Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ |
| A. | 乙烯 | B. | 丙烯 | C. | 2-甲基丙烯 | D. | 2-丁烯 |
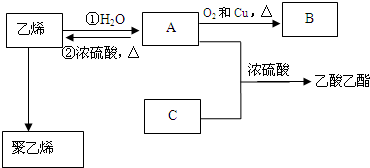
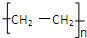 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基.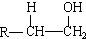 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑. 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题: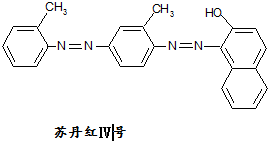 据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.
据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物. 空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.
空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.