题目内容
【题目】研究含碳化合物的结构与性质,对生产、科研等具有重要意义。
(1)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+、CH3-的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+、CH3-的空间构型分别为___、____。
(2)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
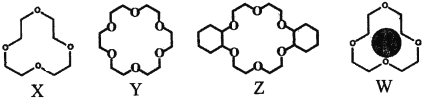
①Li+与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态锂离子核外能量最高的电子所处能层符号为___________;
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构。理由是___________。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________,H-O键键角___________(填“>”“<”或“=”)109°28′
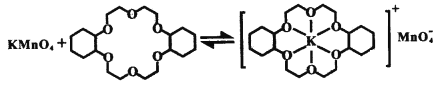
ii.已知:冠醚Z与KMnO4可以发生下图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________。
【答案】洪特规则 平面三角形 三角锥形 K Li+半径比Y的空腔小得多,不易与空腔内氧原子的孤电子对作用形成稳定结构 正四面体 < 冠醚可溶于烯烃,进入冠醚中的K+因静电作用将MnO4-带入烯烃中,增大烯烃与MnO4-接触机会,提升氧化效果
【解析】
(1)当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同;根据价层电子对个数=σ键个数+孤电子对个数计算判断;
(2)①基态锂离子核外只有1s能级上有电子;②冠醚Y空腔较大,Li+半径较小;③i.水分子中氧原子的价层电子对个数是4;水分子中O原子含有2个孤电子对,孤电子对之间的排斥力大于成键电子对和孤电子对之间的排斥力;ii.根据相似相溶原理分析解答。
(1)2p轨道上的2个电子没有分占不同轨道,该电子排布图违背了洪特规则;CH3+中心碳原子的价层电子对个数=3+![]() =3,采用sp2杂化,为平面三角形结构,而CH3-中心碳原子的价层电子对个数=3+
=3,采用sp2杂化,为平面三角形结构,而CH3-中心碳原子的价层电子对个数=3+![]() =4,采用sp3杂化,为三角锥形,故答案为:洪特规则;平面三角形;三角锥形;
=4,采用sp3杂化,为三角锥形,故答案为:洪特规则;平面三角形;三角锥形;
(2)①基态锂离子核外只有1s能级上有电子,为K层上的电子,所以其能层符号为K,故答案为:K;
②冠醚Y空腔较大,Li+半径较小,Li+半径远远小于Y空腔,导致该离子不易与氧原子的孤电子对形成配位键,所以得不到稳定结构,故答案为:Li+半径比Y的空腔小很多,不易与空腔内O原子的孤电子对作用形成稳定结构;
③i.水分子中氧原子的价层电子对个数是4,采用sp3杂化,含有2个孤电子对,氧的杂化轨道的空间构型为四面体;水分子中O原子含有2个孤电子对,孤电子对之间的排斥力大于成键电子对和孤电子对之间的排斥力,导致水分子中键角小于甲烷分子之间键角,小于109°28′,故答案为:四面体;<;
ii.根据相似相溶原理知,冠醚可溶于烯烃,加入冠醚中的钾离子因静电作用将高锰酸根离子带入烯烃中,增大反应物的接触面积,提高氧化效果,故答案为:冠醚可溶于烯烃,加入冠醚中的钾离子因静电作用将高锰酸根离子带入烯烃中,增大反应物的接触面积,提高氧化效果。

【题目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)该实验探究的是_________________________________因素对化学反应速率的影响。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________ mol·L-1(假设混合溶液的体积为50 mL)。
(3)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②_______________________________
Ⅱ:当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为___________________________________
(2)在恒温恒容密闭容器中,判断上述反应达到平衡状态的依据是________________
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
