��Ŀ����
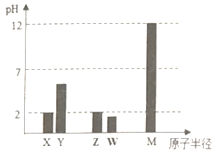
����Ŀ��X��Y��Z��W��MΪ����������Ԫ�أ�25��Cʱ��������������Ӧ��ˮ���Ũ�Ⱦ�Ϊ 0.01mol.L-1)��Һ��pH��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ�������й�˵������ȷ����
A. Y�����������ĵ���ʽΪ��![]()
B. �����̬�⻯������ȶ��ԣ�Z>W
C. X��M����Ԫ���γɵļ����Ӱ뾶��С˳��X<M
D. X���⻯����Z���⻯�ﷴӦ�����ɵĻ������мȺ����Ӽ��ֺ����ۼ�
���𰸡�C
��������X��Y��Z��W��MΪ����������Ԫ�أ�25��Cʱ��������������Ӧ��ˮ���Ũ�Ⱦ�Ϊ 0.01mol.L-1)��Һ��pH��ԭ�Ӱ뾶�Ĺ�ϵ:NaOH��Һ��pHΪ12��MΪNa�������pH=2��XΪNԪ�أ�Y��ӦpH��2��Ϊ̼�ᣬ��YΪC��W��ӦpH��2��Ϊ���ᣬ����WΪS��Z��ӦpH=2����ԭ�������������Z��Cl��
A��YΪ̼Ԫ�أ�Y�����������ΪCO2������ʽΪ��![]() ����A��ȷ��B����Ԫ�صķǽ����Ա���ǿ�������̬�⻯������ȶ��ԣ�Z>W����B��ȷ��C��X��M����Ԫ���γɵļ����Ӱ뾶��С˳��X>M��N3����Na����������Ų���ͬ�����Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС����C����D��X���⻯��NH3��Z���⻯��HCl��Ӧ�����ɵĻ�����NH4Cl��笠��������������γ����Ӽ�����ԭ������ԭ���Թ��õ��Ӷ��γɹ��ۼ�����D��ȷ����ѡC��
����A��ȷ��B����Ԫ�صķǽ����Ա���ǿ�������̬�⻯������ȶ��ԣ�Z>W����B��ȷ��C��X��M����Ԫ���γɵļ����Ӱ뾶��С˳��X>M��N3����Na����������Ų���ͬ�����Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС����C����D��X���⻯��NH3��Z���⻯��HCl��Ӧ�����ɵĻ�����NH4Cl��笠��������������γ����Ӽ�����ԭ������ԭ���Թ��õ��Ӷ��γɹ��ۼ�����D��ȷ����ѡC��

 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�����Ŀ��CO��CO2�ǻ������糧�ͷų�����Ҫβ�����������Ի�����ɸ���Ӱ�죬��Ҳ����Ҫ�Ļ���ԭ�ϣ�����������ǻ��������о����ȵ���⡣
��1��CO ��Cl2�ڴ����������ºϳɹ���(COCl2)��ij�¶��£���2L ���ܱ�������Ͷ��һ������CO��Cl2���ڴ����������·�����Ӧ��CO(g)+Cl2(g)![]() COCl2(g) ��H=a kJ/ mol��
COCl2(g) ��H=a kJ/ mol��
��Ӧ�����вⶨ�IJ����������±���
t/ min | n (CO) /mol | n (Cl2) /mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
�ٷ�Ӧ�ӿ�ʼ��2min ĩ��һ��ʱ���ڵ�ƽ������v(COCl2)=_____mol/(L��min)��
����2min~4min �䣬v (Cl2) ��______v (Cl2)�������������������=���������¶���K=_______��
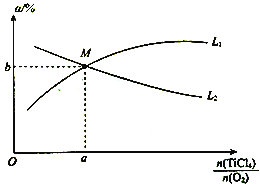
����֪X��L�ɷֱ�����¶Ȼ�ѹǿ��ͼ1��ʾL��ͬʱ��CO��ת������X�ı仯��ϵ��L��������������_____________��a_________0�����������������=������
��2���ڴ���������NO��CO ��ת��Ϊ�����壺
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ��H
2CO2(g)+N2(g) ��H
����֪�� N2(g)+O2 (g)=2NO(g) ��H1= +180.0kJ/mol
2C(s)+O2 (g)=2CO (g) ��H2= -221.0 kJ/mol
2C(s)+2O2 (g)=2CO2 (g) ��H3= -787.0 kJ/mol
��H=____________��
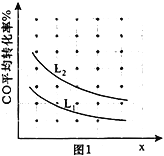
���о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�ijͬѧ���������ʵ�飨ʵ�������Ѿ����������ʵ����Ʊ��У���ʵ������Ŀ����___________________________��
ʵ���� | T���棩 | NO��ʼŨ�� (mol L-1) | CO��ʼŨ�� (mol L-1) | �����ıȱ����(m2 g-1) |
�� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
�� | 280 | 1.20��10-3 | 5.80��10-3 | 124 |
�� | 350 | 1.20��10-3 | 5.80��10-3 | 124 |
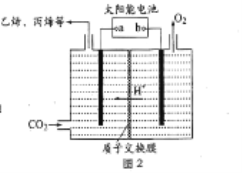
��3����ǿ���Եĵ����ˮ��Һ�У����Բ������缫�����CO2�ɵõ�����ȼ�ϣ���ԭ����ͼ2 ��ʾ��
��b Ϊ��Դ��_______��������������������ʱ�����ɱ�ϩ�ĵ缫��Ӧʽ��_________��
�ں����Ƽ�п�����CO2��NH3��NaCl��Ϊԭ�����Ƶ�NaHCO3�����������������֪H2CO3 ��Ka1=4.3��10-7 molL-1��Ka2=5.6��10-11 molL-1��NaHCO3��Һ�и�����Ũ���ɴ�С��˳��Ϊ________��
����Ŀ��
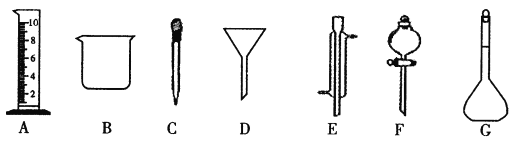
��1��д���������ƣ�E_____________��F_____________��
��2������ʵ��������õ�����D����_________(ѡ������ѡ��ı����ĸ )��
A������ˮ��CC14�Ļ���� B������ˮ�;ƾ��Ļ���� C������ˮ����ɰ�Ļ����
��.ij������ȤС����Ҫ200mL1mol/L��Na2CO3��Һ,��ش��������⣺
��1��������Һ����������ҩƷ��
Ӧ��ȡNa2CO3������ | Ӧѡ������ƿ�Ĺ�� | ������ƿ���Ҫ������������������ͼ�е�______��_____�������� |
��2������ʱ������ȷ�IJ���˳����(����ĸ��ʾ��ÿ������ֻ����һ��)______________��
A��������ȴ����Һ�ز�����ע������ƿ��
B����������ƽȷ��������Na2CO3�������������ձ��У��ټ�������ˮ���ò���������������ʹ���ܽ�(��Ҫʱ�ɼ���)
C��������ˮϴ���ձ�2-3�Σ�ϴ��Һ��ע������ƿ�У���
D�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
E.������ƿ�ǽ�����ҡ��
F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
��3�������������������������ҺŨ�Ƚ��к�Ӱ��(����ƫ��������ƫ����������Ӱ����)?
û�н���C����________��������Һʱ������ƿδ����_________������ʱ���ӿ̶���_________��