题目内容
【题目】
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度![]() )
)
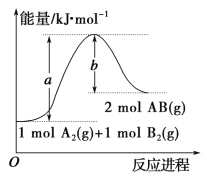
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
![]()
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同 |
B.酯化合成反应的速率与酯分解反应的速率相等 |
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol |
D.体系中乙烯的百分含量一定 |
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
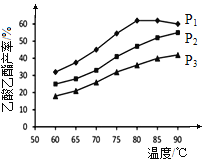
① 温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。
【答案】(1)CH3COOH![]() CH3COO—+ H+(1分) +8.8(1分)
CH3COO—+ H+(1分) +8.8(1分)
(2)![]() (2分)
(2分)
(3)BD(2分)(4)①![]() (P1)﹥
(P1)﹥![]() (P2)﹥
(P2)﹥![]() (P3)(1分) 其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快(1分)②30℅(2分)③由图像可知,P1MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降(2分)
(P3)(1分) 其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快(1分)②30℅(2分)③由图像可知,P1MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降(2分)
④P1MPa、80℃(1分) 通入乙烯气体或增大压强(1分)
【解析】试题分析:(1)若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则有①CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=" -" 46.8kJ·mol-1,②HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=" -" 55.6 kJ·mol-1,则根据盖斯定律可知①-②即得到CH3COOH在水溶液中电离的△H=+8.8kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则溶液中氢离子和醋酸根离子的浓度约为0.1mol/L×1.5%=0.0015mol/L,溶液中醋酸分子的浓度为0.1mol/L-0.0015mol/L,该温度下0.1mol·L-1CH3COOH的电离平衡常数K=![]() 。
。
(3)A.乙烯、乙酸、乙酸乙酯的浓度相同但不一定不变,则不一定达到平衡状态,A;B.酯化合成反应的速率与酯分解反应的速率相等,说明反应达到平衡状态,B正确;C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol均表示逆反应速率相等,反应不一定达到平衡状态,C错误;D.体系中乙烯的百分含量一定说明正逆反应速率相等,反应达到平衡状态,D正确,答案选BD。
(4)①正反应是体积减小的,增大压强乙酸乙酯的产率增大,其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快,所以温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是![]() (P1)﹥
(P1)﹥![]() (P2)﹥
(P2)﹥![]() (P3)。
(P3)。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则根据方程式可知此时乙烯的转化率为30%。
③由图像可知,P1MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降。
④根据测定实验结果分析,较适宜的生产条件是P1MPa、80℃。正反应体积减小,为提高乙酸乙酯的合成速率和产率,可以采取的措施有通入乙烯气体或增大压强。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
反应过程中测定的部分数据见下表(反应过程中条件不变):
t/s | 0 | 50 | 150 | 250 | 350 | 450 | |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x | |
请回答下列问题:
(1) x 的值是________;
(2) 0-50s 内,用PCl3的浓度变化表示的化学反应速率是________;
(3)250s 以后,Cl2的物质的量不再改变的原因是_______________;
(4) 250s 时,容器中Cl2的物质的量是_____,PCl5的物质的量是______,PCl5的转化率是______。