题目内容
在密闭容器中,发生反应H2 (g)+ I2 (g)  2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
(1).升高温度,v正 v逆
(2).加入催化剂, v正 v逆
(3).充入更多的H2 , v正 v逆
(4).取出一定量的I2 , v正 v逆
 (5).增大容器的体积, v正 v逆
(5).增大容器的体积, v正 v逆
(6).容器的体积不变,通入氖气, v正 v逆
 2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。(1).升高温度,v正 v逆
(2).加入催化剂, v正 v逆
(3).充入更多的H2 , v正 v逆
(4).取出一定量的I2 , v正 v逆
 (5).增大容器的体积, v正 v逆
(5).增大容器的体积, v正 v逆 (6).容器的体积不变,通入氖气, v正 v逆
1)增大 增大 (2)增大 增大 (3)增大 开始时不变,随之增大
(4)减小 开始时不变,随之减小 (5)减小 减小 (6)不变 不变
(4)减小 开始时不变,随之减小 (5)减小 减小 (6)不变 不变
本题考查化学平衡的影响因素。(1)升高温度,正逆反应速率都增大;(2)加入催化剂,正逆反应速率都增大;(3)通入氢气,反应物的浓度增大,正反应速率增大,此时逆反应速率不变,随着平衡右移,生成物浓度增大,逆反应速率增大;(4)移去碘单质,反应物浓度减小,正反应速率减小,此时逆反应速率不变,随着反应逆向移动,生成物浓度减小,逆反应速率减小;(5)增大体积,各组分浓度减小,反应速率都减小;(6)通入氖气,因为体积不变,各组分的物质的量不变,所以浓度没有变化,则正逆反应速率都不变。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积分数为10%,下列推断正确的是( )
2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积分数为10%,下列推断正确的是( ) 2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。
2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。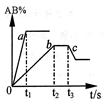
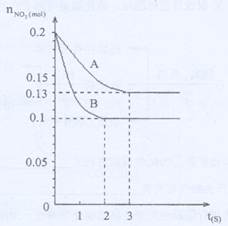
 CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则 2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是( )
2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是( ) 2SO3(气)
2SO3(气)