题目内容
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
【答案】![]() 6 1 3
6 1 3 ![]() 2 1 1 2
2 1 1 2 ![]() 9 3 3 5
9 3 3 5
【解析】
(1)该反应中只有S元素化合价发生变化,先根据化合价升降总数相等配平S元素,再根据原子守恒配平未参加氧化还原反应的元素;
(2)该反应中只有Cl元素化合价发生变化,先根据化合价升降总数相等配平Cl元素,再根据原子守恒配平未参加氧化还原反应的元素;
(3)该反应中只有P元素化合价发生变化,先根据化合价升降总数相等配平P元素,再根据原子守恒配平未参加氧化还原反应的元素。
(1)该反应中只有S元素化合价发生变化,S既作氧化剂又作还原剂,S由0价生成-2价S和+4价S,化合价升降最小公倍数是4,所以反应产生Na2S的系数是2,生成Na2SO3的系数是1,反应消耗S单质系数是3,根据Na元素守恒,可知NaOH的系数是6,根据H元素守恒,可知H2O的系数是3,配平后的方程式为:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O,方程式系数由前到后依次是3、6、1、3;
2Na2S+Na2SO3+3H2O,方程式系数由前到后依次是3、6、1、3;
(2)该反应中只有Cl元素化合价发生变化,Cl2既作氧化剂又作还原剂,Cl元素化合价由反应前Cl2中的0价生成CaCl2中的-1价和Ca(ClO)2中的+1价,化合价升降最小公倍数是2,所以反应物Cl2的系数是2,生成CaCl2、Ca(ClO)2的系数是1,根据Ca元素守恒,可知Ca(OH)2的系数是2,根据H元素守恒,可知H2O的系数是2,配平后的方程式为2Cl2+2Ca(OH)2![]() CaCl2+Ca(ClO)2+2H2O,方程式系数由前到后依次是2、2、1、1、2;
CaCl2+Ca(ClO)2+2H2O,方程式系数由前到后依次是2、2、1、1、2;
(3)该反应中只有P元素化合价发生变化,P4既作氧化剂又作还原剂,P元素化合价由0价生成-3价的PH3和+5价的H3PO4,化合价升降最小公倍数是15,所以反应产生K3PO4的系数是3,生成PH3的系数是5,反应消耗P4单质系数是2,根据K元素守恒,可知KOH的系数是9,根据H元素守恒,可知H2O的系数是3,配平后的方程式为:2 P4+9KOH+3H2O=3K3PO4+5PH3↑,方程式系数由前到后依次是2、9、3、3、5。

【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5mL 0.5mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C-S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C-S-的电子式__________________________。
(2)用离子方程式表示FeSO4溶液显酸性的原因______________________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因___________。
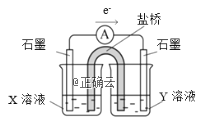
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________________。